Напишите уравнение реакции горения диэтилового эфира
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,247
- разное 16,834
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
9. Напишите уравнение реакции горения диэтилового эфира.

задача №9
к главе «Глава 20 Введение в органическую химию. §20.10 Спирты. Кислоты. Эфиры».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Расчет объема воздуха, необходимого для горения
Расчет объема воздуха, необходимого для горения, предполагает вычисление
а) теоретического объема воздуха Vв теор и б) практического объема воздуха Vв пр , затраченного на горение (с учетом коэффициента избытка воздуха).
Стехиометрическое количество воздуха в уравнении реакции горения предполагает, что при данном соотношении компонентов, участвующих в реакции горения, воздух расходуется полностью. Объем воздуха в данном случае называется теоретическим (Vв теор ).
Горение может происходить не только при стехиометрическом соотношении компонентов, но и при значительном отклонении от него. Как правило, в условиях пожара на сгорание вещества воздуха затрачивается больше, чем определяется теоретическим расчетом. Избыточный воздух DVв в реакции горения не расходуется и удаляется из зоны реакции вместе с продуктами горения. Таким образом, практический объем воздуха равен
и, следовательно, избыток воздуха будет равен
Обычно в расчетах избыток воздуха при горении учитывается с помощью коэффициента избытка воздуха (a). Коэффициент избытка воздуха показывает, во сколько раз в зону горения поступило воздуха больше, чем это теоретически необходимо для полного сгорания вещества:
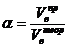
Для горючих смесей стехиометрического состава (т.е. состава, соответствующего уравнению реакции горения) коэффициент избытка воздуха a = 1, при этом реальный расход воздуха равен теоретическому. В этом случае обеспечивается оптимальный режим горения.
При a > 1 горючую смесь называют бедной по горючему компоненту, а при a теор (a -1) (2.4)
В закрытом объеме диффузионное горение большинства горючих материалов возможно только до определенной пороговой концентрации кислорода, так называемой остаточной концентрации кислорода в продуктах горения j (О2) ПГ . Для большинства органических веществ она составляет 12 – 16 % О2. Для некоторых веществ, например, ацетилена С2Н2, ряда металлов, горение возможно и при значительно меньшем содержании кислорода (до 5 % объемных О2).
Зная содержание кислорода в продуктах горения, можно определить коэффициент избытка воздуха (коэффициент участия воздуха в горении) на реальном пожаре:
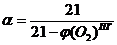
2.1.1. Горючее – индивидуальное химическое соединение
Теоретический объем воздуха, необходимый для горения рассчитывается по уравнению реакции горения.
| Расчет теоретического объема воздуха, необходимого для горения индивидуального вещества | Пример 2.4. Какой теоретический объем воздуха необходим для полного сгорания 1 кг диэтилового эфира С2Н5ОС2Н5? Температура 10 0 С, давление 1,2 ат |
1. Записываем уравнение реакции горения
М = 74 кг 6×4,76 × Vм =
2. Записываем в уравнении известные и неизвестные величины с указанием размерности.
3. Молярная масса диэтилового эфира 74 кг/кмоль. Записываем эту величину под формулой эфира.
4. При нормальных условиях молярный объем (Vм) любого газообразного вещества составляет 22, 4 л/моль или 22,4 м 3 /кмоль.
Если условия отличаются от нормальных, то необходимо определить, какой объем будет занимать 1 кмоль любого газообразного вещества при данных условиях. Расчет VМ ведут по формуле объединенного газового закона:
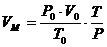
Р и Т – данные в задаче температура и давление.
Рассчитаем, какой объем занимает 1 кмоль воздуха (как и любого другого газообразного вещества) при данных температуре и давлении.
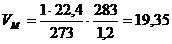

5. По уравнению реакции найдем теоретический объем воздуха, необходимый для полного сгорания эфира:
Vв теор = 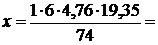
| Расчет объема воздуха, необходимого для горения индивидуального вещества | Пример 2.5. Какой объем воздуха необходим для полного сгорания 50 кг ацетона СН3СОСН3 при температуре 23 0 С и давлении 95 кПа, если горение протекало с коэффициентом избытка воздуха 1,2? |
1. Записываем уравнение реакции горения
М = 58 кг 4×4,76 × Vм =
2. Рассчитаем, какой объем занимает 1 кмоль воздуха (как и любого другого газообразного вещества) при данных температуре и давлении.
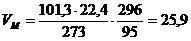

Vв теор = 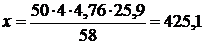
4. По условию задачи коэффициент избытка воздуха a = 1,2.
С учетом этого определим практический объем воздуха, необходимый для горения:
Vв пр = Vв теор × a = 425,1 × 1,2 = 510,1 м 3 .
2.1.2. Горючее – смесь газов и паров
Природный, попутный нефтяной газ, промышленные газы (доменный, коксовый, генераторный и т.п.) представляют собой смеси газов. Состав газов выражается обычно в объемных процентах (j объемн , %).
Алгоритм расчета в данном случае следующий: для каждого горючего компонента вычисляется теоретическое количество воздуха с учетом его концентрации в смеси, и полученные концентрации суммируются. Формула для расчета теоретического объема воздуха для сгорания газовой смеси имеет следующий вид:
Vв теор = 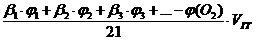
где b1, b2, b3 – стехиометрические коэффициенты при воздухе в уравнении реакции горения для каждого горючего компонента газовой смеси;
j1, j2, j3 – концентрации каждого горючего компонента смеси (в объемных %);
j (О2) – процентное содержание кислорода в горючем газе (в объемных %);
VГГ – объем газовой смеси, м 3 .
Если горение протекает с избытком воздуха, то практический объем воздуха рассчитывают по уже известной формуле:
| Расчет объема воздуха, необходимого для горения газовой смеси | Пример 2.6. Определить объем воздуха, необходимого для полного сгорания 10 м 3 доменного газа следующего состава (в % объемных): оксид углерода (II) СО – 27 %, водород Н2 – 3 %, углекислый газ СО2 – 13 %, метан СН4 – 1 %, азот N2 – 56 %. Горение протекает при a = 1,3. |
1. Определяем стехиометрические коэффициенты в уравнении реакции горения для каждого горючего компонента газовой смеси. Горючими газами в этой смеси являются угарный газ СО, водород Н2 и метан СН4.
2. По формуле (3.6) определяем теоретический объем воздуха, необходимый для горения данной газовой смеси:
Vв теор = 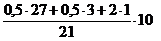
3. С учетом коэффициента избытка воздуха реально на сгорание данной газовой смеси будет затрачено воздуха
Vв пр = Vв теор × a = 8,1 × 1,3 = 10,5 м 3 .
2.1.3. Горючее – сложное вещество с известным элементным составом
Состав таких веществ выражается в массовых долях (w, %) каждого элемента. При горении кислород воздуха расходуется на окисление углерода С, водорода Н, серы S и других горючих составляющих.
Рассчитаем, какой теоретический объем воздуха необходим для сгорания 1 кг каждого элемента при нормальных условиях.
12 кг 4,76×22,4 м 3
Vв(С) теор = х = 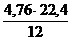
1 кг 0,25×4,76×22,4 м 3
Vв(Н) теор = х = 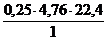
32 кг 4,76×22,4 м 3
Vв(S) теор = х = 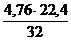
Углерод, водород и сера являются основными составляющими большинства органических соединений. Значительное число органических веществ имеют в своем составе кислород, и, следовательно, воздуха на горение будет затрачено меньше.
Рассчитаем объем воздуха, в котором содержится 1 кг кислорода.
32 кг О2 — 4,76×22,4 м 3 воздуха
Vв(О) теор = х = 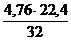
Сопоставим полученные значения.
= 26,665 : 8,885 : 3,332 : 3,332 = 1 : 1/3 : 1/8 : 1/8
Теоретическое количество воздуха для сгорания 1 кг вещества сложного элементного состава в общем виде можно записать следующим образом:
Vв теор = Vв(С) теор × 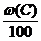
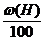
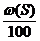
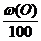
w (С), w (Н), w (S), w (О) – массовые доли элементов в веществе, %.
После подстановки в формулу (2.7) полученных выше расчетных значений теоретический объем воздуха для сгорания заданной массы (m)вещества сложного элементного состава при нормальных условиях определяется по формуле:
Vв теор =m × 0,267 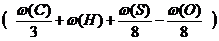
| Расчет объема воздуха, необходимого для горения вещества сложного элементного состава | Пример 2.7. Определить объем воздуха, необходимого для полного сгорания 5 кг торфа следующего состава (в %): С – 56,4 %, Н – 5,04 %, О – 24,0 %, S – 0,06 %, N – 3,6 %, зола – 10,9 %. Горение протекает при a = 1,5, условия нормальные. |
1. По формуле (3.8) определяем теоретический объем воздуха, необходимый для горения данной массы образца торфа:
Vв теор = 5 × 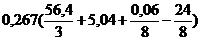
2. С учетом коэффициента избытка воздуха реально на сгорание данной массы образца торфа будет затрачено воздуха
Vв пр = Vв теор × a = 27,7 × 1,5 = 41,6 м 3 .
http://5terka.com/node/9935
http://mydocx.ru/4-41370.html
