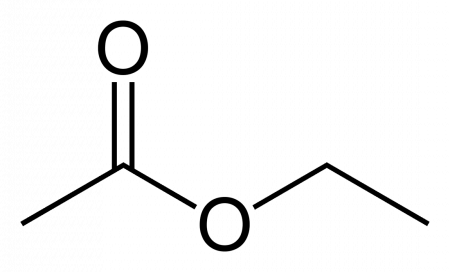
Этилацетат
| Этилацетат | |||
|---|---|---|---|
| |||
| Хим. формула | C4H8O2 | ||
| Рац. формула | CH3-COO-CH2-CH3 | ||
| Молярная масса | 88,11 г/моль | ||
| Плотность | 0,902 г/см³ | ||
| Поверхностное натяжение | 25,13 ± 0,01 мН/м , 23,39 ± 0,01 мН/м , 20,49 ± 0,01 мН/м , 17,58 ± 0,01 мН/м и 14,68 ± 0,01 мН/м | ||
| Динамическая вязкость | 0,578 ± 0,001 мПа·с , 0,423 ± 0,001 мПа·с , 0,325 ± 0,001 мПа·с и 0,259 ± 0,001 мПа·с | ||
| Энергия ионизации | 10,01 ± 0,01 эВ | ||
| Температура | |||
| • плавления | −84 °C | ||
| • кипения | 77 °C | ||
| • вспышки | 24 ± 1 °F и −4 ± 1 °C | ||
| Пределы взрываемости | 2 ± 1 об.% и 2 ± 0,1 об.% | ||
| Давление пара | 73 ± 1 мм рт.ст. , 10 ± 1 кПа , 12,6 ± 0,1 кПа и 100 ± 1 кПа | ||
| Показатель преломления | 1,3720 | ||
| Дипольный момент | 1,78 ± 0,09 Д | ||
| ГОСТ | ГОСТ 8981-78 ГОСТ 22300-76 | ||
| Рег. номер CAS | 141-78-6 | ||
| PubChem | 8857 | ||
| Рег. номер EINECS | 205-500-4 | ||
| SMILES | |||
| Кодекс Алиментариус | E1504 | ||
| RTECS | AH5425000 | ||
| ChEBI | 27750 | ||
| ChemSpider | 8525 | ||
| Токсичность | малотоксично | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Этилацетат (этиловый эфир уксусной кислоты) CH3−COO−CH2−CH3 — бесцветная летучая жидкость с резким запахом.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Применение
- 3.1 Лабораторное применение
- 4 Очистка и сушка
- 5 Охрана труда
Получение
Этилацетат образуется при прямом взаимодействии этанола с уксусной кислотой (реакция этерификации):
Лабораторный метод получения этилацетата заключается в ацетилировании этилового спирта хлористым ацетилом или уксусным ангидридом:
К промышленным способам синтеза этилацетата относятся:
- Перегонка смеси этилового спирта, уксусной и серной кислот.
- Обработка этилового спирта кетеном.
- Дегидратация этилового спирта при повышенных температурах и давлении.
- Синтез по реакции Тищенко из ацетальдегида при 0-5 °C в присутствии каталитических количеств алкоголята алюминия:
2CH3CHO → CH3COOC2H5
Физические свойства
Бесцветная подвижная жидкость с резким запахом эфира. Молярная масса 88,11 г/моль, температура плавления −83,6 °C, температура кипения 77,1 °C, плотность 0,9001 г/см³, n 20 4 1,3724. Растворяется в воде 12 % (по массе), в этаноле, диэтиловом эфире, бензоле, хлороформе; образует двойные азеотропные смеси с водой (т. кип. 70,4 °C, содержание воды 8,2 % по массе), этанолом (71,8; 30,8), метанолом (62,25; 44,0), изопропанолом (75,3; 21,0), CCl4 (74,7; 57), циклогексаном (72,8; 54,0) и тройную азеотропную смесь Э.: вода: этанол (т. кип. 70,3 °C, содержание соотв. 83,2, 7,8 и 9 % по массе).
Применение
Этилацетат широко используется как растворитель, из-за низкой стоимости и малой токсичности, а также приемлемого запаха. В частности, как растворитель полиуретана, нитроцеллюлозы, ацетилцеллюлозы, жиров, восков, для чистки печатных плат, в смеси со спиртом — растворитель в производстве искусственной кожи. Годовое мировое производство в 1986 году составляло 450—500 тысяч тонн, в 2014 год — около 3,5 млн тонн в год.
Один из самых популярных ядов, применяемых в энтомологических морилках для умерщвления насекомых. Насекомые после умертвления в его парах гораздо мягче и податливее в препарировании, чем после умерщвления в парах хлороформа.
Обладая фруктовым запахом применяется как компонент фруктовых эссенций. Зарегистрирован в качестве пищевой добавки E1504 (ароматизатор). Добавляется в состав водок (либо образуется при реакции содержащегося в них этилового спирта с добавляемыми уксусной кислотой или уксуснокислыми солями) для смягчения запаха и вкуса спирта.
Лабораторное применение
Этилацетат часто используется для экстракции, а также для колоночной и тонкослойной хроматографии. Редко в качестве растворителя для проведения реакций из-за склонности к гидролизу и переэтерефикации.
Используется для получения ацетоуксусного эфира:
Очистка и сушка
Продажный этилацетат обычно содержит воду, спирт и уксусную кислоту. Для удаления этих примесей его промывают равным объёмом 5 % карбоната натрия, сушат хлоридом кальция и перегоняют. При более высоких требованиях к содержанию воды несколько раз (порциями) добавляют фосфорный ангидрид, фильтруют и перегоняют, защищая от влаги. С помощью молекулярного сита 4А содержание воды в этилацетате можно снизить до 0,003 %.
Охрана труда
Предельно-допустимая концентрация этилацетата в воздухе рабочей зоны составляет 50 мг/м 3 (среднесменная, за 8 часов) и 200 мг/м 3 (максимально-разовая). Но по данным порог восприятия запаха в группе людей (среднее значение) может достигать, например, 1120 мг/м³. А у отдельных людей он может быть значительно больше среднего значения. По этой причине можно ожидать, что использование широко распространённых фильтрующих СИЗОД в сочетании с «заменой фильтров по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками) приведёт к чрезмерному воздействию паров этилацетата на, по крайней мере, часть работников — из-за запоздалой замены противогазных фильтров. Для защиты от этилацетата следует использовать более эффективные изменение технологии и средства коллективной защиты.
ЛД50 для крыс составляет 11,6 г/кг, показывая низкую токсичность. Пары этилацетата раздражают слизистые оболочки глаз и дыхательных путей, при действии на кожу вызывают дерматиты и экземы. ПДК в воздухе рабочей зоны 200 мг/м³. ПДК в атмосферном воздухе населенных мест 0,1 мг/м³.
Температура вспышки — 2 °C, температура самовоспламенения — 400 °C, концентрационные пределы взрыва паров в воздухе 2,1—16,8 % (по объёму).
Безопасность при транспортировке: в соответствии с ДОПОГ (ADR) класс опасности 3, код по реестру ООН 1173.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Методическое пособие по выполнению контрольной работы для слушателей заочной формы обучения специальность 280104. 65 «Пожарная безопасность»Главная > Методическое пособие
ГОСУДАРСТВЕННОЙ ПРОТИВОПОЖАРНОЙ СЛУЖБЫ ТЕОРИЯ ГОРЕНИЯ И ВЗРЫВА Методическое пособиепо выполнению контрольной работыдля слушателей заочной формы обученияспециальность 280104.65 – «Пожарная безопасность» Рецензенты:Н.И. Ивановдоктор технических наук, профессор,заслуженный деятель науки РФ(Балтийский государственный технический университет)И.Д. Чешкодоктор технических наук, профессор(ВНИИПО МЧС России)Коробейникова Е.Г.Теория горения и взрыва: методические рекомендации по выполнению контрольной работы для слушателей заочной формы обучения по специальности 280104.65 – «Пожарная безопасность» / Под общей ред. В.С. Артамонова. ¾ СПб.: Санкт-Петербургский университет ГПС МЧС России, 2008 – 53 с. Методические рекомендации предназначены для организации заочного обучения курса «Теория горения и взрыва». Рассмотрена методика решения расчетных задач по курсу ТГиВ, примеры решений. Для выполнения расчетов в приложении приведены справочные таблицы. Для выполнения контрольной работы по курсу предложены варианты теоретических вопросов и расчетных заданий. Санкт-Петербургский университет ГПС МЧС России, 2008 Приступая к изучению курса «Теория горения и взрыва», необходимо ознакомиться с программой, настоящими методическими указаниями и списком рекомендуемой литературы. Усвоив основные теоретические положения отдельных тем курса, слушатель может переходить к решению задач по этой дисциплине. Слушатель должен выполнить одну контрольную работу, включающую теоретическую часть (два вопроса) и расчетную часть. Задание на контрольную работу состоит из 100 вариантов. Вариант контрольной работы определяется по таблице 1 по двум последним цифрам номера зачетной книжки. Например, номер зачетной книжки 761 25 . Следовательно, вариант контрольной работы 25. По таблице 1 определяем номера теоретических вопросов и расчетного задания : 29, 46, 25. Вещество для расчетного задания выбирается по таблице 2. В данном случае это будет диметиловый эфир (№ 25). Работа должна быть выполнена разборчивым почерком, грамотно и аккуратно оформлена. При затруднении в самостоятельном решении какого-либо вопроса или задачи можно обратиться за консультацией к практическим работникам пожарной охраны или преподавателям университета. Оценивается работа с учетом глубины изложения материала, правильности решения задач, самостоятельности выполнения, умения увязывать теоретические вопросы с практикой работы пожарной охраны. Таблица 1. Задания для выполнения контрольной работы Две последние цифры номера зачетной книжки Номера вопросов и заданий Две последние цифры номера зачетной книжки Номера вопросов и заданий I . Теоретические вопросы 1. Сущность процесса горения. Условия, необходимые для горения. Полное и неполное горение. Продукты горения, дым. 2. Виды горения (пламен): гомогенное и гетерогенное, кинетическое и диффузионное, ламинарное и турбулентное. 3. Классификация пожаров по пожарной нагрузке, виды пожарной нагрузки, ее размерность. 4. Массовая скорость выгорания, ее размерность; линейная скорость выгорания, ее размерность. Зависимость скорости выгорания от различных факторов. 5. Чем отличается низшая теплота горения от высшей? Какой закон используют для определения теплоты горения индивидуальных веществ? Как называется формула для расчета низшей теплоты горения конденсированных систем (смесей известного элементного состава)? 6. Температура горения веществ и материалов. Чём отличается теоретическая температура от действительной, от адиабатической? Какие факторы влияют на температуру горения? 7. Самовоспламенение, сущность процесса. Температура самовоспламенения, ее практическое значение, как показателя пожарной опасности веществ и материалов. 8. В чем суть радикально-цепного процесса самовоспламенения? Назовите причины обрыва цепи. Как влияют температура и давление на развитие цепного процесса самовоспламенения? 9. Тепловая теория самовоспламенения академика Н. Н. Семенова. Изобразить графически и объяснить изменение тепловыделения и теплоотвода от температуры. 10. Практическое значение температуры самовоспламенения как показателя пожарной опасности. От каких факторов зависит температура самовоспламенения? 11. Как можно увеличить теплоотвод при самовоспламенении? Как изменится при этом температура самовоспламенения? Принцип работы гравийных, сетчатых и др. огнепреградителей, щелевой защиты. 12. Сущность процесса самовозгорания. В чем отличие самовозгорания от самовоспламенения? Причины и условия самовозгорания. 13. Причины и условия самовозгорания жиров и масел. Какие масла наиболее склонны к самовозгоранию? Что называется йодным числом? Меры профилактики, исключающие самовозгорание жиров и масел. 14. Причины и условия самовозгорания веществ на воздухе (сульфиды железа, белый фосфор, порошки металлов). Меры профилактики. 15. Причины и условия самовозгорания веществ в контакте с водой (щелочные металлы, карбиды, гидриды я т.д.). Меры профилактики. 16. Причины и условия самовозгорания каменного угля. Меры профилактики. 17. Самовозгорание веществ при контакте друг с другом (смеси горючего с окислителем). Меры профилактики, исключающие самовозгорание веществ при контакте друг с другом. 18. В чем отличие самовоспламенения от зажигания? Какой процесс называется зажиганием? Виды источников зажигания. Минимальная энергия зажигания, ее практическое значение, как показателя пожарной опасности веществ и материалов. 19. Дефлаграционное горение газо-паровоздушных смесей. Нормальная скорость распространения пламени, ее практическое значение, как показателя пожарной опасности веществ. 20. Практическое значение, нормальной скорости горения. Зависимость ее от концентрации горючего в смеси, от начальной температуры и от концентрации флегматизаторов. 21. Концентрационные пределы распространения пламени (КПР) их практическое значение, как показателя пожарной опасности веществ. 22. Изменение КПР в гомологическом ряду (на примере ряда метана). Влияние на КПР функциональных групп и ненасыщенных связей, температуры, давления, флегматизаторов и ингибиторов. 23. Чем отличается детонационное горение от дефлаграционного горения? Условия возникновения детонационного горения? II . Расчетная часть задания 1. Общие сведения 2. Физико-химические свойства Агрегатное состояние; внешний вид, цвет, запах; плотность;. температура плавления; температура кипения; растворимость в воде; коэффициент молекулярной диффузии пара; удельное электрическое сопротивление; диэлектрическая проницаемость; предельно допустимая концентрация ПДК (справочные данные). 2.1 . Расчет относительной плотности паров по воздуху (D возд ); 2.2. Расчет плотности паров при нормальных условиях ( пар = М/V м , кг/м 3 ); 2.3. Расчет процентного элементного состава вещества. 2.4. Расчет коэффициента горючести. 3. Расчет характеристик горения 3.1. Определение характера свечения пламени. 3.2. Низшая теплота сгорания По формуле Д.И. Менделеева в кДж/кг. 3.3. Уравнение реакции горения. 3.4. Объем воздуха на горение (теоретический и практический) По уравнению реакции горения (для 1 кг горючего вещества при нормальных условиях). 3.5. Объем и состав продуктов горения (теоретический) По уравнению реакции горения (для 1 кг горючего вещества при нормальных условиях). 3.6. Стехиометрическая концентрация в паровоздушной смеси 3.6.1. Объемная концентрация (%). 3.6.2. Массовая концентрация (кг/м 3 , г/м 3 ). 3.7. Концентрационные пределы распространения пламени 3.8. Расчет давления насыщенного пара по уравнению Антуана (для температуры 25 0 С). Таблица 2. Физико-химические константы некоторых веществ источники: http://acetyl.ru/o/a29ka2.php http://gigabaza.ru/doc/37812-pall.html |