В уравнении реакции горения фосфора в избытке кислорода коэффициент перед формулой восстановителя равен :а) 3 ; б) 5 ; в)4 ; г)1?
Химия | 5 — 9 классы
В уравнении реакции горения фосфора в избытке кислорода коэффициент перед формулой восстановителя равен :
а) 3 ; б) 5 ; в)4 ; г)1.
Коэффициент перед формулой восстановителя равен : в) 4
В уравнении реакции горения фосфора в избытке кислорода коэффициент перед формулой восстановителя равен : а)3 б)5 в)4 г)1 Подскажитеееее плииииз?
В уравнении реакции горения фосфора в избытке кислорода коэффициент перед формулой восстановителя равен : а)3 б)5 в)4 г)1 Подскажитеееее плииииз.
Коэффициент перед формулой восстановителя в уравнении реакции горения алюминия в кислороде равен 1) 1 2) 2 3) 3 4) 4?
Коэффициент перед формулой восстановителя в уравнении реакции горения алюминия в кислороде равен 1) 1 2) 2 3) 3 4) 4.
В уравнении реакции горения фосфора в избытке кислорода коэффициент перед формулой восстановителя равен а)3 б)5 в)4 г)1 почему?
В уравнении реакции горения фосфора в избытке кислорода коэффициент перед формулой восстановителя равен а)3 б)5 в)4 г)1 почему?
Коэффициент перед формулой восстановителя в уравнении реакции горения пентана равен : а — 1 б — 3 в — 3 г — 4?
Коэффициент перед формулой восстановителя в уравнении реакции горения пентана равен : а — 1 б — 3 в — 3 г — 4.
Сумма коэффициентов в уравнении реакции горения фосфора в избытке кислорода равна 1)5 2)7 3)9 4)11?
Сумма коэффициентов в уравнении реакции горения фосфора в избытке кислорода равна 1)5 2)7 3)9 4)11.
Составьте уравнения реакций следующих превращенийН2О — О2 — СаО — Са(ОН)2Для окислительно — восстановительных реакций составьте схемы электронного баланса?
Составьте уравнения реакций следующих превращений
Н2О — О2 — СаО — Са(ОН)2
Для окислительно — восстановительных реакций составьте схемы электронного баланса.
2 задание в уравнении реакции горения фосфора в избытке кислорода коэффициент перед формулой восстановителя чему равен ?
Известно что в организме человека содержится по массе 65 процентов кислорода .
Вычислите сколько химического элемента кислорода содержится в вашем организме вычислите в кг.
Напишите уравнение реакции горения фосфора в избытке кислорода?
Напишите уравнение реакции горения фосфора в избытке кислорода.
Составьте уравнение реакции горения фосфора?
Составьте уравнение реакции горения фосфора.
Коэффициент перед формулой восстановления равен : 1, 2, 5, 4.
Написать уравнение реакций горения в кислороде — фосфора?
Написать уравнение реакций горения в кислороде — фосфора.
Составьте уравнение химической реакции между кислородом (в избытке) и фосфором?
Составьте уравнение химической реакции между кислородом (в избытке) и фосфором.
В ответе укажите коэффициент возле формулы кислорода.
На странице вопроса В уравнении реакции горения фосфора в избытке кислорода коэффициент перед формулой восстановителя равен :а) 3 ; б) 5 ; в)4 ; г)1? из категории Химия вы найдете ответ для уровня учащихся 5 — 9 классов. Если полученный ответ не устраивает и нужно расшить круг поиска, используйте удобную поисковую систему сайта. Можно также ознакомиться с похожими вопросами и ответами других пользователей в этой же категории или создать новый вопрос. Возможно, вам будет полезной информация, оставленная пользователями в комментариях, где можно обсудить тему с помощью обратной связи.
22 * 2 = 44 44 — 32 = 12 значит, это СО2, или, проще сказать, углерод.
Потому что элементы соединяясь друг с другом образуют соединения.
P2O5 + 6NaOH→2Na3PO4 + 3H2O H2SO4 + 2NaOH→2H2O + Na2SO4 H2SO4 + Zn→ZnSO4 + H2 H2SO4 + MgCO3→MgSO4 + CO2 + H2O H2SO4 + 2AgNO3→2HNO3 + Ag2SO4 2NaOH + Zn0→Na2ZnO2 + H2 2NaOH + MgCO3→Mg(OH)2 + Na2CO3 2NaOH + 2AgNO3→Ag2O + 2NaNO3 + H2O Zn + 2AgNO3→2Ag + Z..
СвойстваЭтилен(другое название —этен) — химическое соединение, описываемое формулой С2H4. В природе этилен практически не встречается. Это бесцветный горючий газ со слабым запахом. Частичнорастворим в воде(25, 6 мл в 100 мл воды при 0°C), этаноле ..
Жозеф Луи Пруст открыл закон постоянства веществ.
Caco3 + 2hno3 = h20 + c02 + ca(no3)2 n (caco3) = 280 * 0. 1 : 100 = 0. 28 V(co2) = 6. 272дм³.
А)Дано : O2 V = 11, 2 лm — ? N — ? Решение : m = n • M, N = n • NA n = V / Vm = 11, 2 / 22, 4 = 0, 5 моль M(O2) = 16 • 2 = 32 г / моль m = 0, 5 • 32 = 16 г, N = 0, 5 • 6 • 1023 = 3 • 1023молекул Ответ : m(O2) = 16 г, N(O2) = 3 •1023молекул. Б)Дано..
Решение находится на фото.
T = 273 К P = 101325 Па R = 8, 314 Дж / (моль * л) p = 999800 г / м³ PV = m(NH₃)RT / M(NH₃) m(NH₃) = PVM(NH₃) / RT m(H₂O) = Vp w = m(NH₃) /
Смотри, пишешь массы веществ, которые должны прореагировать, дальше сокращаешь их пока не получается. В таких долях и надо будет взять вещества, чтобы они прореагировали.
Уравнение реакции горения фосфора в избытке
16 лет успешной работы в сфере подготовки к ЕГЭ и ОГЭ!
1602 поступивших (100%) в лучшие вузы Москвы
Подготовка к ЕГЭ, ОГЭ и предметным Олимпиадам в Москве
| До окончания записи осталось: | |||||||
| Записаться на экспресс-курс! | |||||||
- home
- map
У Вас возникли вопросы?
Мы обязательно Вам перезвоним:
На видео представлен процесс горения фосфора в кислороде – смотрите подробности в ролике.
Фосфор легко окисляется кислородом. В лаборатории можно произвести реакцию взаимодействия фосфора и кислорода (видео). Для этого поджигается порошок красного фосфора и затем опускается в колбу, наполненную кислородом. Происходит интенсивное горение фосфора. Наблюдается ослепительно белое пламя с образованием густого белого дыма. Белый дым – это высший оксид фосфора (фосфорный ангидрид), который оседает на стенках колбы.
В зависимости от концентрации кислорода в процессе горения образуются разные соединения фосфора с кислородом. В процессе горения фосфора с избытком кислорода получается фосфорный ангидрид (Р2О5). Фосфористый ангидрид (Р2О3) получается в результате горения при недостатке кислорода или в процессе медленного окисления.
Уравнения реакций окисления фосфора:
- при избытке кислорода 4P + 5O2 → 2P2O5;
- при медленном окислении или при недостатке кислорода 4P + 3O2 → 2P2O3.
Фосфористый ангидрид очень токсичный, как и белый фосфор.
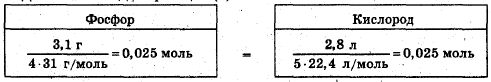
Составьте термохимическое уравнение реакции горения фосфора
Составьте термохимическое уравнение реакции горения фосфора, если известно, что на горение израсходовали 3,1 г фосфора и 2,8 л кислорода nри нормальных условиях и при этом выделилось 75,25 кДж теплоты.
При горении фосфора возможны две реакции:
Определим, какое из веществ находится в избытке. Для реакции (1):
В избытке кислорода образуется Р2O5
Действительно, для реакции (2):
Фосфор и кислород находятся в стехиометрическом соотношении. Данные для определения теплового эффекта:
http://paramitacenter.ru/node/376
http://allxumuk.ru/content/sostavte-termohimicheskoe-uravnenie-reakcii-goreniya-fosfora