Расчеты горения
Расчеты горения ведут по химическим уравнениям реакций, используя законы газового состояния: Бойля – Мариотта 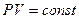
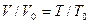
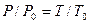
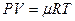
Рассмотрим реакцию горения водорода в кислороде: 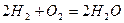
Рассмотрим реакцию горения метана в кислороде: 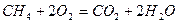
В практических условиях сжигание газа осуществляется в воздухе. Примем состав сухого воздуха: О2 – 21 %, N2 – 79%. Следовательно, 1 м 3 кислорода содержится в 100/21 = 4,76 м 3 воздуха. Или на 1 м 3 кислорода приходится 3,76 м 3 азота. Отсюда условная формула воздуха: (О2 + 3,76N2).
Запишем реакцию горения водорода в воздухе:
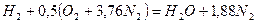
Из уравнения следует, что при нормальных условиях для полного сгорания 1 м 3 водорода требуется 0,5 × 4,76 = 2,38 м 3 воздуха. Таким образом, для сгорания 1 м 3 водорода требуется 2,38 м 3 воздуха. В результате образуются продукты сгорания: 1 м 3 воды в виде пара и 1,88 м 3 азота.
Запишем реакцию горения метана в воздухе:
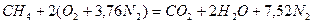
Из уравнения следует, что для полного сгорания 1 м 3 метана необходимо 2 × 4,76 = 9,52 м 3 воздуха. Таким образом, при нормальных условиях для сгорания 1 м 3 метана требуется 9,52 м 3 сухого воздуха. Продукты сгорания содержат 1 м 3 диоксида углерода, 2 м 3 паров воды и 7,52 м 3 азота.
Запишем реакцию горения пропана в воздухе:
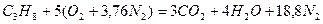
Из уравнения видно, что для полного сгорания 1 м 3 пропана необходимо 5 × 4,76 = 23,8 м 3 воздуха. Таким образом, при нормальных условиях для сгорания 1 м 3 пропана требуется 23,8 м 3 сухого воздуха.
Приведенные расчеты выполнены для стехиометрических уравнений и полученные соотношения воздуха и газа называются стехиометрическими. Например, для горения метана в воздухе стехиометрическое соотношение – 9,52. В реальных условиях воздуха может не хватать для полного сгорания газа или, напротив, воздух подается в избыточном количестве. Для характеристики реальных соотношений воздуха и газа в процессе горения введена безразмерная величина: коэффициент избытка воздуха (окислителя) – коэффициент α. Для стехиометрического соотношения α = 1. Если имеет место недостаток воздуха, то α 1. Например, в процессе горения израсходовано 23 м 3 воздуха и 2 м 3 метана. Подсчитываем коэффициент α. Реальное соотношение воздуха и газа 23/2 = 11,5. Отсюда α = 11,5/9,52 = 1,2.
Выше показано, как можно подсчитывать необходимое количество воздуха для сгорания и определять объем продуктов сгорания для индивидуальных газов. Но обычно используемый газ – смесь различных газов. В этом случае расчет теоретически необходимого объема воздуха (воздуха сухого) ведется по формуле:
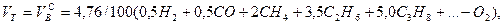
где 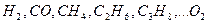
Используемый для сжигания атмосферный воздух содержит влагу, поэтому расчет объема влажного воздуха производят по формуле:
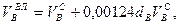
где 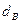
0,00124 – объем 1 г водяного пара.
И, наконец, определяется объем воздуха действительный с учетом величины коэффициента α по формуле:
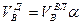
Пример. Имеется газ состава СН4 – 95%, С3Н8 – 5%. Определить объем воздуха действительного для сжигания данного газа при α = 1,1 и 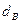

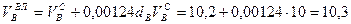
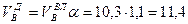
Объем продуктов сгорания газовой смеси определяется по следующим формулам.
Объем диоксида углерода
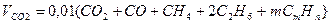
Объем водяных паров
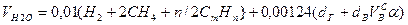
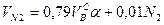
где N2 – процентное содержание азота в газовой смеси.
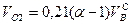
Суммарный объем продуктов сгорания

Дата добавления: 2015-06-22 ; просмотров: 8105 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Взаимодействие метана с кислородом. Реакция горения
Самый простой представитель алканов
Метан — это газообразное химическое соединение, химическая формула вещества — CH₄. Метан не имеет запаха, не имеет вкуса и является нетоксичным веществом. Предел воспламеняемости газа — его концентрация в воздухе от 5 до 15%.
Основные характеристики метана
Метан — самый простой представитель алканов. Эту группу органических соединений называют предельными, насыщенными или парафиновыми углеводородами. Они имеют простую связь между атомами углерода в молекуле, остальные валентности каждого углеродного атома насыщены атомами водорода. Самая важная реакция алканов — горение. Горят алканы с образованием паров воды и газообразной двуокиси углерода. В результате этой реакции в огромных количествах выделяется химическая энергия, которую можно преобразовать в электрическую или тепловую.
Горение метана используется для получения горячих дымовых газов, энергия которых обеспечивает работу газовой турбины. Во многих населенных пунктах метан подается по трубам в дома и используется для внутреннего отопления и приготовления пищи. Если сравнивать с другими видами углеводородного топлива, сжигание природного газа (метана) характеризуется меньшим выделением углекислого газа и большим количеством выделяемого тепла. Здесь вы найдете интересные эксперименты для изучения различных газов.
Метан с кислородом: реакция горения
Процесс горения метана — это взаимодействие метана с кислородом. В результате реакции образуется вода, двуокись углерода и много энергии. Уравнение реакции горения метана:
CH₄[газ] + 2O₂[газ] → CO₂[газ] + 2H₂O[пар] + 891кДж
Описание реакции
1 молекула метана при взаимодействии с 2 молекулами кислорода образует 1 молекулу двуокиси углерода и 2 молекулы воды. В процессе реакции выделяется тепловая энергия, равная 891 кДж.
Природный газ — самое чистое для сжигания ископаемое, имеющее простой состав и не выделяющее в воздух вредных химических веществ. Так как природный газ на 95% состоит из метана, то при его сжигании побочные продукты почти не образуются, или их образуется намного меньше, чем при использовании других видов ископаемого топлива.
Если внести в пламя метана фарфоровую крышку от тигля, она не закоптится, так как входящий в состав метана углерод сгорает полностью. Некоптящее пламя — это качественная реакция на предельные углеводороды.
Уравнение реакции горения метана в воздухе
Горением называют быстро протекающую во времени химическую реакцию соединения горючих компонентов топлива с кислородом воздуха, сопровождающуюся интенсивным выделением теплоты, света и продуктов сгорания.
Для метана реакция горения с воздухом:
Для СУГ:
Продуктами полного сгорания газов являются водяные пары (H2O), диоксид углерода (CO2) или углекислый газ.
При полном сгорании газов цвет пламени, как правило, голубовато-фиолетовый.
Объемный состав сухого воздуха принимается: O2≈ 21%, N2 ≈ 79%, из этого след., что
1м 3 кислорода содержится в 4,76м 3 (≈5 м 3 ) воздуха.
Вывод: для сжигания
— 1м 3 метана необходимо 2м 3 кислорода или около 10м 3 воздуха,
— 1м 3 пропана – 5м 3 кислорода или около 25м 3 воздуха,
— 1м 3 бутана – 6,5м 3 кислорода или около 32,5м 3 воздуха,
— 1м 3 СУГ
6м 3 кислорода или около 30м 3 воздуха.
Практически при сжигании газа водяные пары, как правило, не конденсируются, а удаляются вместе с другими продуктами сгорания. Поэтому технические расчеты ведут по низшей теплоте сгорания Qн.
Условия, необходимые для горения:
1. наличие топлива (газа);
2. наличие окислителя (кислорода воздуха);
3. наличие источника температуры воспламенения.
Неполное сгорание газов.
Причиной неполного сгорания газа является недостаточное количество воздуха.
Продуктами неполного сгорания газов являются оксид углерода или угарный газ (CO), несгоревшие горючие углеводороды (CnHm) и атомарный углерод или сажа.
Для природного газа CH4 + O2 → CO2 + H2O + CO + CH4 + C
Для СУГ CnHm + O2 → CO2 + H2O + CO + CnHm + C
Наиболее опасным является появление угарного газа, который действует на организм человека отравляюще. Образование сажи придает пламени желтую окраску.
Неполное сгорание газа опасно для здоровья человека (при содержании 1% СО в воздухе 2-3 вздоха для человека достаточно, чтобы отравиться со смертельным исходом).
Неполное сгорание неэкономично (сажа препятствует процессу передачи тепла, при неполном сгорании газа мы недополучаем тепло, ради которого сжигаем газ).
Для контроля полноты сгорания обращают внимание на цвет пламени, которое при полном сгорании должно быть голубым, а при неполном сгорании – желтовато-соломенным. Наиболее совершенный способ контроля полноты сгорания – анализ продуктов сгорания с помощью газоанализаторов.
Способы сжигания газа.
Понятие о первичном и вторичном воздухе.
Существуют 3 способа сжигания газа:
1) диффузионный,
2) кинетический,
3) смешанный.
Диффузионный способ или способ без предварительного смешения газа с воздухом.
Из горелки в зону горения поступает только газ. Воздух, необходимый для горения, смешивается с газом в зоне горения. Этот воздух называется вторичным.
Пламя вытянутое, желтого цвета.
a= 1,3÷1,5 t ≈ (900÷1000) о С
Кинетический способ – способ с полным предварительным смешением газа с воздухом.
В горелку подается газ и подается воздух дутьевым устройством. Воздух, необходимый для горения и который подается в горелку для предварительного смешения с газом, называется первичным.
Пламя короткое, зеленовато-синеватого цвета.
a= 1,01÷1,05 t≈ 1400 о С
Смешанный способ – способ с частичным предварительным смешиванием газа с воздухом.
Газ инжектирует первичный воздух в горелку. В зону горения из горелки поступает газовоздушная смесь с недостаточным для полного сгорания количеством воздуха. Остальной воздух – вторичный.
Пламя средних размеров, зеленовато-голубоко цвета.
a=1,1¸1,2 t ≈1200 о С
Коэффициент избытка воздуха a=Lпр./Lтеор. — это отношение количества воздуха, необходимого для горения на практике к количеству воздуха, необходимого для горения и теоретически посчитанного.
Всегда должен быть a>1, в противном случае будет недожог.
Lпр.=a∙Lтеор., т.е. коэффициент избытка воздуха показывает во сколько раз количество воздуха, необходимого для горения на практике больше количества воздуха, необходимого для горения и посчитанного теоретически.
http://melscience.com/RU-ru/articles/vzaimodejstvie-metana-s-kislorodom-reakciya-goreni/
http://angor.ru/pomoshch/stati/gorenie-gaza
