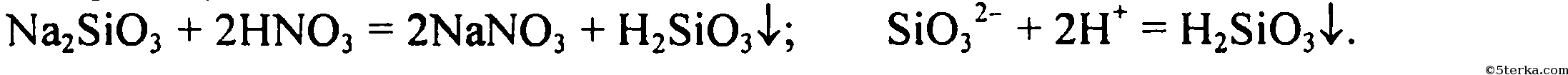Уравнение реакции hno3 с солью
I. Нитраты (селитры)
Азотная кислота – одноосновная, образует один ряд солей – нитраты состава:
Нитраты калия, натрия, кальция и аммония называют селитрами. Например, селитры:KNO3 – нитрат калия (индийская селитра), NаNО3 – нитрат натрия (чилийская селитра), Са(NО3)2 – нитрат кальция (норвежская селитра), NH4NO3 – нитрат аммония (аммиачная или аммонийная селитра, ее месторождений в природе нет). Германская промышленность считается первой в мире, получившей соль NH4NO3 из азота N2 воздуха и водорода воды, пригодную для питания растений.
Рис.1. Аммиачная селитра Рис.2. Калиевая селитра Рис.3. Натриевая селитра
II. Физические свойства
Нитраты – вещества с преимущественно ионным типом кристаллических решёток. При обычных условиях это твёрдые кристаллические вещества, все нитраты хорошо растворимы в воде, сильные электролиты.
III. Получение нитратов
Нитраты образуются при взаимодействии:
1) Металл + Азотная кислота
2) Основный оксид + Азотная кислота
3) Основание + Азотная кислота
4) Аммиак + Азотная кислота
5) Соль слабой кислоты + Азотная кислота
В cоответствии с рядом кислот каждая предыдущая кислота может вытеснить из соли последующую:
6) Оксид азота (IV) + щёлочь
в присутствии кислорода —
IV. Химические свойства нитратов
I. Общие с другими солями
1) Взаимодействие с металлами
Металл, стоящий в ряду активности левее, вытесняет последующие из их солей:
2) Взаимодействие с кислотами
3) Взаимодействие со щелочами
4) Взаимодействие с cолями
II. Специфические
Все нитраты термически неустойчивы. При нагреванииразлагаются с образованием кислорода. Характер других продуктов реакции зависит от положения металла, образующего нитрат, в электрохимическом ряду напряжений:
1) Нитраты щелочных (исключение — нитрат лития) и щелочноземельных металлов разлагаются до нитритов:
2) Нитраты менее активных металлов от Mg до Cu включительно и нитрат лития разлагаются до оксидов:
3) Нитраты наименее активных металлов (правее меди) разлагаются до металлов:
4) Нитрат и нитрит аммония:
Нитрат аммония разлагается в зависимости от температуры так:
Качественная реакция на нитрат-ион NO3 – – взаимодействие нитратов c металлической медью при нагревании в присутствии концентрированной серной кислоты или с раствором дифениламина в Н2SO4 (конц.).
Опыт: “Качественная реакция на ион NO3 – “
Признаки реакции — в пробирке появляются бурые пары оксида азота(IV), что лучше наблюдать на белом экране, а на границе медь – реакционная смесь появляются зеленоватые кристаллы нитрата меди(II).
Протекают следующие уравнения реакций:
V. Применение нитратов
Почему азота в природе много (он входит в состав атмосферы), а растения часто дают плохой урожай из-за азотного голодания?
Растения не могут усваивать молекулярный азот N2 из воздуха. Это проблема «связанного азота». При недостатке азота задерживается образование хлорофилла, поэтому растения имеют бледно-зеленую окраску, как следствие, задерживается рост и развитие растения. Азот – жизненно важный элемент. Без белка нет жизни, а без азота нет белка.
Как же усваивается атмосферный азот? Часть связанного азота поступает в почву во время гроз. Химия процесса такова:
Существуют растения способные повышать плодородие почвы, в чем же их особенность? Эти растения (люпин, люцерна, клевер, горох, вика) относятся к семейству бобовых (мотыльковые), на корнях которых развиваются клубеньковые бактерии, способные связывать атмосферный азот, переводя его в соединения, доступные для растений.
Растения, связывающие атмосферный азот
Снимая урожаи, человек ежегодно уносит вместе с ними огромные количества связанного азота. Эту убыль он покрывает внесением не только органических, но и минеральных удобрений (нитратных, аммиачных, аммонийных). Азотные удобрения вносят под все культуры. Азот усваивается растениями в виде катиона аммония NH4 + и нитрат-аниона NO3 – .
«Классификация азотных удобрений»
Одной из важных характеристик является содержание питательного элемента в удобрении. Расчет питательного элемента для азотных удобрений ведут по содержанию азота.
Влияние нитратов на окружающую среду и организм человека
Азот как основной питательный элемент влияет на рост вегетативных органов – зеленых стеблей и листьев. Азотные удобрения не рекомендуется вносить поздней осенью или ранней весной, т. к. талые воды смывают до половины удобрений. Важно соблюдать нормы и сроки внесения удобрений, вносить их не сразу, а в несколько приемов. Применять медленно действующие формы удобрений (гранулы, покрытые защитной пленкой), при посадке использовать сорта, склонные к низкому накоплению нитратов. Коэффициент использования азотных удобрений – 40–60%. Избыточное употребление азотных удобрений не только ведет к аккумуляции нитратов в растениях, но и приводит к загрязнению ими водоемов и грунтовых вод. Антропогенными источниками загрязнения водоемов нитратами являются также металлургия, химическая, в том числе целлюлозно-бумажная, и пищевая отрасли промышленности. Одним из признаков загрязнения водоемов является «цветение» воды, вызванное бурным размножением синезеленых водорослей. Особенно интенсивно оно происходит во время таяния снега, летних и осенних дождей. Предельно допустимая концентрация (ПДК) нитратов регламентируется ГОСТом. Для суммы нитрат-ионов в почве принято значение 130 мг/кг, в воде разных водоисточников – 45 мг/л. (ПДК (NO3 – в почве) – 130 мг/кг, ПДК (NO3 – в воде) – 45 мг/л.).
Для самих растений нитраты безвредны, а вот для человека и травоядных животных они опасны. Смертельная доза нитратов для человека – 8–15 г, допустимое суточное потребление – 5 мг/кг. Многие растения способны накапливать большие количества нитратов, например: капуста, кабачки, петрушка, укроп, свекла столовая, тыква и др.
Такие растения называют нитратонакопителями. В организм человека 70% нитратов поступает с овощами, 20% – с водой, 6% – с мясом и рыбой. Попадая в организм человека, часть нитратов всасывается в желудочно-кишечном тракте в неизмененном виде, другая часть, в зависимости от присутствия микроорганизмов, значения рН и других факторов, может превращаться в более ядовитые нитриты, аммиак, гидроксиламин NН2ОН; в кишечнике из нитратов могут образоваться вторичные нитрозамины R2N–N=О, обладающие высокой мутагенной и канцерогенной активностью. Признаки небольшого отравления – слабость, головокружение, тошнота, расстройство желудка и т. д. Снижается работоспособность, возможна потеря сознания.
В организме человека нитраты взаимодействуют с гемоглобином крови, превращая его в метгемоглобин, в котором железо окислено до Fe 3+ и не может служить переносчиком кислорода. Именно поэтому один из признаков острого отравления нитратами – синюшность кожных покровов. Выявлена прямая зависимость между случаями появления злокачественных опухолей и интенсивностью поступления в организм нитратов при избытке их в почве.
Опыт: “Исследование содержания нитратов в продуктах питания”
(качественная реакция на нитрат-ион NO3 – )
Первая помощь при отравлении нитратами
Первая помощь при отравлении нитратами – это обильное промывание желудка, прием активированного угля, солевых слабительных – глауберовой соли Na2SO4•10H2O и английской соли (горькая соль) MgSO4•7H2O, cвежий воздух.
Уменьшить вредное влияние нитратов на организм человека можно с помощью аскорбиновой кислоты (витамина С); если ее соотношение с нитратами составляет 2:1, то нитрозамины не образуются. Доказано, что прежде всего витамин С, а также витамины Е и А являются ингибиторами – веществами, предотвращающими и тормозящими процессы преобразования нитратов и нитритов в организме человека. Необходимо ввести в рацион питания побольше черной и красной смородины, других ягод и фруктов (кстати, в висячих плодах нитратов практически нет). И еще один естественный нейтрализатор нитратов в организме человека – это зеленый чай.
Причины накопления нитратов в овощах и способы выращивания экологически чистой продукции растениеводства
Наиболее интенсивно азот поглощается во время роста и развития стеблей и листьев. При созревании семян потребление азота из почвы практически прекращается. Плоды, достигшие полной зрелости, уже не содержат нитратов – происходит полное превращение соединений азота в белки. Но у многих овощей ценится именно незрелый плод (огурцы, кабачки). Удобрять такие культуры азотными удобрениями желательно не позднее чем за 2–3 недели до уборки урожая. Кроме того, полному превращению нитратов в белки препятствуют плохая освещенность, избыточная влажность и несбалансированность питательных элементов (недостаток фосфора и калия). Не следует увлекаться внесезонными тепличными овощами. Например, 2 кг тепличных огурцов, съеденных за один прием, могут вызвать опасное для жизни отравление нитратами. Надо также знать, преимущественно в каких частях растения накапливаются нитраты: у капусты – в кочерыжке, у моркови – в сердцевине, у кабачков, огурцов, арбузов, дыни, картофеле – в кожуре. У дыни и арбуза не следует есть незрелую мякоть, прилежащую к корке. Огурцы лучше почистить и срезать место прикрепления их к стеблю. У зеленных культур нитраты накапливаются в стеблях (петрушка, салат, укроп, сельдерей). Содержание нитратов в различных частях растений неравномерно: в черешках листьев, стебле, корне содержание их в 1,5–4,0 раза выше, чем в листьях. Всемирная организация здравоохранения считает допустимым содержание нитратов в диетических продуктах до 300 мг NO3 – на 1 кг сырого вещества. (ПДК (NO3 – в диетических продуктах) – 300 мг/кг.). Если самое высокое содержание нитратов отмечается в свекле, капусте, салате, зеленом луке, то самое низкое содержание нитратов – в репчатом луке, томатах, чесноке, перце, фасоли.
Чтобы вырастить экологически чистую продукцию, прежде всего необходимо грамотно вносить азотные удобрения в почву: в строго рассчитанных дозах и в оптимальные сроки. Выращивать овощи, особенно зеленные культуры, надо при хорошей освещенности, оптимальных показателях влажности почвы и температуры. И все же для уменьшения содержания нитратов овощные культуры лучше подкармливать органическими удобрениями. Несвоевременное внесение удобрений, особенно в избыточных дозах, в том числе и органического удобрения – навоза, приводит к тому, что поступившие в растение минеральные соединения азота не успевают полностью превратиться в белковые.
Нитраты в производстве взрывчатых веществ
Многие взрывчатые смеси содержат в своем составе окислитель (нитраты металлов или аммония и др.) и горючее (дизельное топливо, алюминий, древесную муку). Поэтому соли – нитрат калия, нитрат бария, нитрат стронция и другие – применяются в пиротехнике.
Азотное удобрение нитрат аммония вместе с алюминием и древесным углем входит в состав взрывчатой смеси – аммонала. Основная реакция, которая протекает при взрыве:
Высокая теплота сгорания алюминия повышает энергию взрыва. Применение нитрата аммония в составе аммонала основано на его свойстве разлагаться при детонации с образованием газообразных веществ:
В руках террористов взрывчатые вещества приносят мирным людям только страдания.
Шесть веков продолжалось господство черного пороха в военном деле. Теперь его применяют в качестве взрывчатого вещества в горном деле, в пиротехнике (ракеты, фейерверки), а также как охотничий порох. Черный или дымный порох – это смесь 75% нитрата калия, 15% древесного угля и 10% серы.
Нитрат серебра AgNO3, который чернит ткань, бумагу, парты и руки (ляпис), применяют как противомикробное средство для лечения кожных язв, для прижигания бородавок и в качестве противовоспалительного средства при хроническом гастрите и язве желудка: пациентам назначают пить 0,05%-й раствор АgNO3. Порошкообразные металлы Zn, Мg, Al, cмешанные с нитратом серебра, используют в петардах.
Основный нитрат висмута Вi(ОН)2NО3 назначают внутрь при язвенной болезни желудка и двенадцатиперстной кишки в качестве вяжущего и антисептического средства. Наружно – в мазях, присыпках при воспалительных заболеваниях кожи.
Соль нитрит натрия NaNО2 применяют в медицине как спазмолитическое средство.
Применение нитритов в пищевой отрасли промышленности
Нитриты применяют в колбасном производстве: 7 г на 100 кг фарша. Нитриты придают колбасе розовый цвет, без них она серая, как вареное мясо, и не имеет товарного вида. К тому же присутствие нитритов в колбасе необходимо еще и по другой причине: они предотвращают развитие микроорганизмов, выделяющих токсичные яды.
3 Большинство солей азотной кислоты растворимы в воде, тем не менее предложите уравнение реакции HNO3 с солью, в результате которой образуется осадок. Напишите ионное уравнение этой реакции.
3 Большинство солей азотной кислоты растворимы в воде, тем не менее предложите уравнение реакции HNO3 с солью, в результате которой образуется осадок. Напишите ионное уравнение этой реакции.

задача №3
к главе «Глава 3. Неметаллы. § 27(26). Кислородные соединения азота».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Азотная кислота: получение и химические свойства
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например , концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
2. В промышленности азотную кислоту получают из аммиака . Процесс осуществляется постадийно.
1 стадия. Каталитическое окисление аммиака.
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
Химические свойства
Азотная кислота – это сильная кислота . За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства .
1. Азотная кислота практически полностью диссоциирует в водном растворе.
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , азотная кислота взаимодействует с оксидом меди (II):
Еще пример : азотная кислота реагирует с гидроксидом натрия:
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например , азотная кислота взаимодействует с карбонатом натрия:
4. Азотная кислота частично разлагается при кипении или под действием света:
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
Таблица . Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например , азотная кислота окисляет серу, фосфор, углерод, йод:
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором . Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
7. Концентрированная а зотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например , азотная кислота окисляет оксид серы (IV):
Еще пример : азотная кислота окисляет иодоводород:
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например , сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
При нагревании до серной кислоты:
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
http://5terka.com/node/10557
http://chemege.ru/azotnaya-kislota/