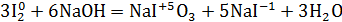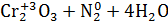Йодид натрия: способы получения и химические свойства
Йодид натрия NaI — соль щелочного металла натрия и йодоводородной кислоты. Белый, при хранении на свету желтеет из-за окисления. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 149,90; относительная плотность для тв. и ж. состояния d = 3,667; tпл = 661º C;
Способ получения
1. Йодид натрия можно получить путем взаимодействия горячего гидроксида натрия, пероксида водорода и йода, образуются йодид натрия, газ кислород и вода:
если гидроксид натрия будет холодным и к нему вместе с йодом добавить газ сероводород, то в результате данной реакции произойдет образование йодида натрия, осадка серы и воды:
2NaOH + I2 + H2S = 2NaI + S↓ + 2H2O
2. При температуре 150–200º C, в результате взаимодействия натрия и брома, образуется йодид натрия:
2Na + I2 = 2NaI
3. Разбавленный раствор гидроксида натрия реагирует с йодидом железа в атмосфере азота . При этом образуются йодид натрия и осадок гидроксид железа:
2NaOH + FeI2 = 2NaI + Fe(OH)2↓
Качественная реакция
Качественная реакция на йодид натрия — взаимодействие его с нитратом серебра, в результате реакции происходит образование осадка желтого цвета:
1. При взаимодействии с нитратом серебра , йодид натрия образует нитрат натрия и осадок йодид серебра:
NaI + AgNO3 = NaNO3 + AgI↓
Химические свойства
1. Йодид натрия разлагается при температуре выше 1400º C с образованием натрия и йода:
2NaI = 2Na + I2
2. Йодид натрия вступает в реакцию с простыми веществами :
2.1. Холодный йодид натрия взаимодействует с хлором. В результате реакции происходит образование хлорида натрия и осадка йода:
2NaI + Cl2 = 2NaCl + I2↓
2.2. Холодный йодид натрия взаимодействует с бромом. В результате реакции происходит образование бромида натрия и осадка йода:
2NaI + Br2 = 2NaBr + I2↓
3. Йодид натрия способен вступать в реакцию со сложными веществами :
3.1. Йодид натрия реагирует с кислотами-окислителями :
3.1.1. Твердый йодид натрия реагирует с серной кислотой при 30 — 50º С. Взаимодействие данных веществ приводит к образованию осадка йода, газа сероводорода, воды и гидросульфата натрия:
3.1.2. При кипении, в результате взаимодействия твердого йодида натрия и концентрированной азотной кислоты образуются осадок йод, газ оксид азота (IV), вода и нитрат натрия:
4. Йодид натрия способен вступать в реакцию с соединениями железа (III) :
NaI + FeCl3 = FeCl2 + I2↓ + NaCl
Опыт 3. Реакция диспропорционирования
Помещу в пробирку 1-2 кристалла йода I2, 3-5 капель концентрированного раствора щелочи NaOH и нагрею. Изменение цвета раствора: фиолетовый раствор → бордовый раствор.
1.Уравнение реакции, учитывая, что продуктом окисления йода в щелочной среде является йода натрия NaIO3.
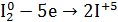
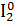
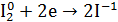
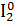
2.Общий вывод: Вещество содержит элемент в промежуточной степени окисления и
молекулы этого элемента реагируют друг с другом как окислитель и как восстановитель. Это вещество может участвовать в реакциях диспропорционирования.
Опыт 4. Внутримолекулярная реакция
1.В сухую пробирку помещу небольшое количество 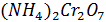

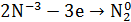
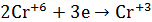
2.Вывод: эта реакция – реакция внутримолекулярная.
Иод: решение задач методом электронного баланса
Подробно решение уравнений окислительно-восстановительных реакций (ОВР) методом электронного баланса разобраны на странице «Метод электронного баланса».
Ниже приведены примеры уравнений окислительно-восстановительных реакций иода.
Если в окислительно-восстановительной реакции принимают участие простые вещества, молекулы которых состоят из двух или более атомов элементов, то в электронном балансе кол-во отданных и полученных электронов определяют с учётом кол-ва атомов в молекуле: H2 0 -2e — → 2H +1 .
Уравнения окислительно-восстановительных реакций иода
1. Уравнение реакции иода с хлором (I2+Cl2):
2. Уравнение реакции иода с хлорноватой кислотой (I2+HClO3):
3. Уравнение реакции иода с хлорной кислотой (I2+HClO4):
4. Уравнение реакции иода с броматом калия (I2+KBrO3):
5. Уравнение реакции иода с сероводородом (I2+H2S):
6. Уравнение реакции иода с сернистым ангидридом в нейтральной среде с образованием иодоводорода и серной кислоты:
7. Уравнение реакции иода с сульфитом калия в щелочной среде с образованием сульфата калия, иодида калия и воды:
8. Уравнение реакции иода с разбавленной азотной кислотой с образованием иодноватой кислоты, оксида азота и воды:
9. Уравнение реакции иода с фосфором с образованием иодида фосфора:
10. Уравнение реакции иодной воды (I2 0 +H2O) с фосфором с образованием фосфористой кислоты и иодоводорода:
11. Уравнение реакции иодной воды с фосфином:
12. Уравнение реакции иодной воды с метаарсенитом и карбонатом натрия с обраозованием дигидроарсенита натрия, иодида натрия и углекислого газа:
13. Уравнение реакции иода с пероксидом водорода с образованием иодноватой кислоты и воды:
14. Уравнение реакции иода с горячим гидроксидом натрия с образованием иодида и иодата натрия и воды:
15. Уравнение реакции иода с алюминием с образованием иодида алюминия:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
http://mydocx.ru/4-83062.html
http://prosto-o-slognom.ru/chimia_ovr/zadachi_01_I_meb.html