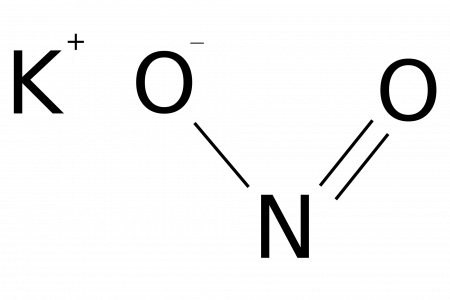
Нитрат калия: способы получения и химические свойства
Нитрат калия KNO3 — соль щелочного металла калия и азотной кислоты. Белый. Плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 101,10; относительная плотность для тв. и ж. состояния d = 2,109; tпл = 334, 5º C;
Способ получения
1. Нитрат калия можно получить при 70º С путем взаимодействия надпероксида калия и оксида азота (IV), образуется нитрат калия и кислород:
2. В результате взаимодействия разбавленной азотной кислоты и гидроксида калия образуется нитрат калия и вода:
3. В результате реакции между горячим гидроксидом калия, оксидом азота (IV) и кислородом, происходит образование нитрата калия и воды:
4. В результате взаимодействия горячего и разбавленного раствора нитрита калия и кислорода образуется нитрат калия:
5. При смешивании горячего пероксида водорода и нитрита калия в разбавленной серной кислоте происходит образование нитрата калия и воды:
Качественная реакция
Качественная реакция на нитрат калия — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат калия образует сульфат калия, нитрат меди, газ оксид азота и воду:
Химические свойства
1. Hитрат калия разлагается при температуре 400–520º С с образованием нитрита калия и кислорода:
2. Н итрат калия может реагировать с простыми веществами :
2.1. Н итрат калия реагирует со свинцом при температуре 350–400 ºС . При этом образуется нитрит калия и оксид свинца:
KNO3 + Pb = KNO2 + PbO
2.2. Нитрат калия реагирует при температуре 400º С с алюминием с образованием алюмината калия, оксида алюминия и азота:
2.3. Нитрат калия взаимодействует с атомным водородом в присутствии цинка и разбавленной соляной кислоты при этом образуются нитрит калия и вода:
при взаимодействии нитрата калия и водорода при кипении в присутствии алюминия и концентрированного гидроксида калия образуется газ аммиак, вода и гидроксид калия:
3KNO3 + 8Al + 5KOH+ 18H2O = 3NH3↑ + 8K[Al(OH)4]
3. Возможны реакции между нитратом калия и сложными веществами :
3.1. Нитрат калия вступает в реакцию с кислотами :
3.1.1. В результате реакции в вакууме между нитратом калия и концентрированной серной кислотой образуется гидросульфат калия и азотная кислота:
3.2. Нитрат калия взаимодействует с солями :
3.2.1. Нитрат калия реагирует с сульфатом аммония при нагревании. В результате данной реакции образуются сульфат калия, оксид азота (I) и вода:
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Нитрит калия
Нитрит калия (азотистокислый калий) — калиевая соль азотистой кислоты с формулой KNO2. Представляет собой белый или слегка желтоватый кристаллический гигроскопический порошок. Очень хорошо растворим в воде. На воздухе медленно окисляется до нитрата калия КNO3. Пищевая добавка E249. Используется как улучшитель окраски и консервант в пищевой промышленности в изделиях из мяса и рыбы. Содержание
СвойстваНитрит калия образует бесцветные или слегка желтоватые высоко гигроскопичные кристаллы, моноклинной сингонии, пространственная группа I m, параметры ячейки a = 0,677 нм, b = 0,499 нм, c = 0,445 нм, β = 101,75°, Z = 2. Очень хорошо растворим в воде, растворение сопровождается понижением температуры. Раствор имеет слабо щелочную реакцию из-за гидролиза по аниону. Кристаллы разрушаются при 360 °C (до достижения точки плавления которая равна 440 °C или 441 °C, при 100 КПа по данным польской и английской Википедии и 438 °C при давлении в 101325 Па, энтальпия плавления — 17 кДж/моль). Выше этой температуры разлагается по схеме: Как и нитрит натрия является окислителем особенно при повышенных температурах и реагирует с металлами такими как алюминий (особенно в порошкообразной форме), обезвоженными соединениями аммония такими как сульфат аммония, цианидами и многими органическими соединениями. На воздухе медленно доокисляется до нитрата калия KNO3 : Нитриты можно выявить по характеристической реакции с сульфатом железа (II) в присутствии концентрированной серной кислоты (по образованию коричневого окрашивания). Нахождение в природе и способы полученияВ природе, нитриты появляются на промежуточных этапах азотного цикла — как при нитрификации (присоединении азота к соединениям) так и при денитрификации (отсоединении азота от соединений). В промышленности нитрит калия получают при реакции оксидов азота с гидроксидом калия. Получается при окислении свинца нитратом калия: или в процессе термического разложения: Применение
Биологическое действиеТоксичен при проглатывании, при получении больших доз вызывает раздражение, цианоз, конвульсии, смерть (образует метгемоглобин). Раздражает кожу и глаза. Летальная доза LD50 для кроликов 200 мг/кг. Поступление нитритов с пищей оценивается в 31-185 или 40-100 мг в день. В питьевой воде, согласно требованиям ВОЗ 1970 и 2004 гг, допускается содержание нитритов не более 44-50 мг на литр. Приемлемые уровни потребления нитритов для людей 3,7 — 7 мг / кг. источники: http://acetyl.ru/o/nk3n1.php http://chem.ru/nitrit-kalija.html | |||||||||||||||||||||||||||||||||||||||||