Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Cоставьте уравнение реакции между уксусной кислотой и гидроксидом кальция в молекулярном, полном и сокращенном ионном виде?Химия | 5 — 9 классы Cоставьте уравнение реакции между уксусной кислотой и гидроксидом кальция в молекулярном, полном и сокращенном ионном виде. 2CH3COOH + Ca(OH)2 — > (CH3COO)2Ca + 2H2O 2CH3COO( — ) + 2H( + ) + Ca(OH)2 — > Ca( + 2) + 2CH3COO( — ) + 2H2O 2H( + ) + Ca(OH)2 — > Ca( + 2) + 2H2O. Составьте уравнение реакции нейтрализации гидроксида кальция соляной кислотой в молекулярном и ионном виде?Составьте уравнение реакции нейтрализации гидроксида кальция соляной кислотой в молекулярном и ионном виде. Запишите молекулярные, полные и сокращенные ионные уравнения реакций между растворами :а) сульфат алюминия и гидроксид калияб) азотная кислота и гидроксид бария?Запишите молекулярные, полные и сокращенные ионные уравнения реакций между растворами : а) сульфат алюминия и гидроксид калия б) азотная кислота и гидроксид бария. Составьте уравнение реакции в молекулярном, полном ионном, сокращенном ионном виде между гидроксидом бария и сульфатом натрия?Составьте уравнение реакции в молекулярном, полном ионном, сокращенном ионном виде между гидроксидом бария и сульфатом натрия. Написать уравнение реакции взаимодействия хлорида бария с серной кислотой в молекулярном, полном и сокращенном ионном виде?Написать уравнение реакции взаимодействия хлорида бария с серной кислотой в молекулярном, полном и сокращенном ионном виде. Составьте уравнение реакции взаимодействия углерода (IV) оксида с кальций гидроксидом в молекулярной форме ; полной и сокращенной ионных формах?Составьте уравнение реакции взаимодействия углерода (IV) оксида с кальций гидроксидом в молекулярной форме ; полной и сокращенной ионных формах. Гидроксид натрия образуется при взаимодействии : а)карбоната натрия и гидроксида калия б)карбоната натрия и гидроксида кальция в)оксида натрия и воды г)нитрата натрия и гидроксида кальция Написать ура?Гидроксид натрия образуется при взаимодействии : а)карбоната натрия и гидроксида калия б)карбоната натрия и гидроксида кальция в)оксида натрия и воды г)нитрата натрия и гидроксида кальция Написать уравнения возможных реакций в молекулярном , полном и сокращенно ионно — молекулярном виде. Напишите молекулярные, полные и сокращенные ионные уравнения реакций между веществами :А)гидроксидом калия и серной кислотойБ)нитратом серебра и хлоридом кальцияВ)карбонатом натрия и азотной кислотой?Напишите молекулярные, полные и сокращенные ионные уравнения реакций между веществами : А)гидроксидом калия и серной кислотой Б)нитратом серебра и хлоридом кальция В)карбонатом натрия и азотной кислотой. Уравнения реакции взаимодействия уксусной кислоты в молекулярном, ионном и сокращенном ионном виде с гидроксидом калия?Уравнения реакции взаимодействия уксусной кислоты в молекулярном, ионном и сокращенном ионном виде с гидроксидом калия. 3. Составьте уравнение химической реакции кальция с азотной кислотой?3. Составьте уравнение химической реакции кальция с азотной кислотой. 4. Составьте уравнение реакции нейтрализации гидроксида кальция соляной кислотой в молекулярном и ионном виде. Уравнение реакции Уксусная кислота + мел в молекулярной, полной и сокращенной ионной форме?Уравнение реакции Уксусная кислота + мел в молекулярной, полной и сокращенной ионной форме. На этой странице находится ответ на вопрос Cоставьте уравнение реакции между уксусной кислотой и гидроксидом кальция в молекулярном, полном и сокращенном ионном виде?, из категории Химия, соответствующий программе для 5 — 9 классов. Чтобы посмотреть другие ответы воспользуйтесь «умным поиском»: с помощью ключевых слов подберите похожие вопросы и ответы в категории Химия. Ответ, полностью соответствующий критериям вашего поиска, можно найти с помощью простого интерфейса: нажмите кнопку вверху страницы и сформулируйте вопрос иначе. Обратите внимание на варианты ответов других пользователей, которые можно не только просмотреть, но и прокомментировать. Аллотропия это явление существование нескольких простых вещест, которые были образованы от одного химического элемента, например, кислород имеет две основные аллотропные модификации — газ кислород (О2) и газ озон (О3). N(Cl2O7) = 2моль Найти : N(Cl2O7) Решение : N = 6. 02 * 10 ^ 23моль * 2моль N = 12. 04. C6H14 + H2 = C6H16. Всё очень просто. Это обозначение электронных уровней. Цифры под ними — количество электронов. Все вместе называется «схема строения электронной оболочки элемента». Количество электронных уровней определяется по номеру периода. Для того же алюминия : Электронная ф.. А) Zn + Cl₂ = ZnCl₂ цинк и хлор простые вещества, поэтому их степень окисления равна нулю, в хлориде цинка у цинка степень окисления стала + 2, а у хлора — ( — 1), т. Е. у цинка степень окисления повышается с 0 до + 2, а у хлора понижается с 0 до ( .. Ацетат кальция
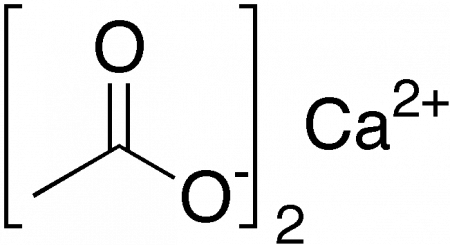
Ацетат кальция — кальциевая соль уксусной кислоты. Бесцветное кристаллическое или аморфное вещество, хорошо растворимое в воде. Технический моногидрат может быть в форме гранул или некрупных игл. Обладает слабым вкусом и запахом уксуса. Химическая формула — Ca(CH3COO)2, однако чаще получают его моногидрат Ca(CH3COO)2•H2O. Содержание
История названияПригорело-древесная соль — старинное название ацетата кальция — в старину получалась при сухой перегонке древесины, из-за чего древесина, естественно, обугливалась, «пригорала». Из-за того, что метод сухой перегонки древесины использовался алхимиками с незапамятных времён, установить человека, давшего такое название этой соли или впервые получившего её, невозможно. ПолучениеВ лаборатории получают действием уксусной кислоты на карбонат, оксид или гидроксид кальция. ПрименениеНе имеет промышленного применения. Используется в лаборатории для получения диметилкетона (ацетона). Эту реакцию осуществляют, нагревая ацетат кальция до 160 °С: Именно из-за этой реакции ацетат кальция нельзя хранить или сушить вблизи открытого огня, а помещения, в которых происходят работы с ацетатом кальция, должны быть оборудованы приточно-вытяжной вентиляцией. Также может применяться в лаборатории для получения сложных эфиров уксусной кислоты — алкилацетатов: Также ацетат кальция используется для получения ацетата калия обменными реакциями из карбоната и/или бикарбоната калия: Также ацетат кальция применяют при получении лавсана в качестве катализатора. Ещё одним способом применения ацетата кальция является приготовление аналога сухого спирта — твёрдого спиртового сольвата ацетата кальция — при смешивании ацетата кальция и этилового спирта. Пищевая промышленностьАцетат кальция зарегистрирован в пищевой промышленности в качестве пищевой добавки группы консервантов E263. Может применяться как консервант, регулятор кислотности, уплотнитель растительных тканей. Останавливает развитие болезнетворных бактерий в хлебобулочных изделиях, смягчает ярко выраженный кислый вкус консервированных овощей и фруктов. В сельскохозяйственной промышленности используется для консервации кормов. Так как действие ацетата кальция ограничено наличием в продуктах сульфатов, фосфатов, карбонатов и гидрокарбонатов, которые в конечном итоге дают осадки с катионом Ca 2+ , то применять его лучше в сочетании с другими консервантами.
МедицинаАцетат кальция оказывает абсорбирующее действие на анионы фосфорных кислот: Также ацетат кальция восстанавливает положительный кальциевый баланс у больных с почечной недостаточностью в легкой, средней и тяжелой форме и у больных, находящихся на гемодиализе или перитонеальном диализе. Является безалюминиевым и безмагниевым фосфат-связывающим препаратом (фосфат-биндером). Фосфат-связывающая способность ацетата кальция в 2 раза выше, а всасываемость его в кишечнике значительно меньше, чем у кальция карбоната. источники: http://himia.my-dict.ru/q/7966670_costavte-uravnenie-reakcii-mezdu-uksusnoj-kislotoj/ http://chem.ru/acetat-kalcija.html | |||||||||||||||||||||||||||||||||||||||||||||||||||||||