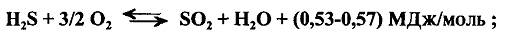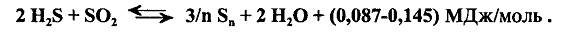Сероводород
Сероводород
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1 о .
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Сероводород: решение задач методом электронного баланса
Подробно решение уравнений окислительно-восстановительных реакций (ОВР) методом электронного баланса разобраны на странице «Метод электронного баланса».
Ниже приведены примеры решения задач ОВР сероводорода (См. Свойства сероводорода).
Если в окислительно-восстановительной реакции принимают участие простые вещества, молекулы которых состоят из двух или более атомов элементов, то в электронном балансе кол-во отданных и полученных электронов определяют с учётом кол-ва атомов в молекуле: H2 0 -2e — → 2H +1 .
Уравнения окислительно-восстановительных реакций сероводорода
1. Уравнение реакции окисления сероводорода при недостатке кислорода с образованием серы и воды:
2. Уравнение реакции окисления сероводорода в избытке кислорода с образованием сернистого ангидрида и воды:
3. Уравнение реакции окисления железа в сероводородной среде с образованием сульфида железа и воды:
4. Уравнение реакции окисления серебра в сероводородной среде с образованием сульфида серебра и воды:
5. Уравнение реакции сероводорода с цинком с образованием сульфида цинка и газообразного водорода:
6. Уравнение реакции сероводорода с сернистым ангидридом с образованием серы и воды:
7. Уравнение реакции сероводорода с концентрированной серной кислотой:
8. Уравнение реакции сероводорода с концентрированной серной кислотой при высокой температуре:
9. Уравнение реакции сероводорода с оксидом железа:
Поскольку часть сульфид-ионов из молекул сероводорода окисляется до серы, а другая — переходит без изменения степени окисления в состав молекул сульфида железа, поэтому, в первую очередь уравнивают коэффициенты перед FeS и S, и только потом ставится коэффициент перед H2S.
10. Уравнение реакции сероводорода с дихроматом калия в кислой среде:
11. Уравнение реакции сероводорода с перманганатом калия:
12. Уравнение реакции сероводорода с хлоридом железа:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Окислительная конверсия сероводорода в элементную серу (процесс Клауса)
Сероводород, получаемый с гидрогенизационных процессов переработки сернистых и высокосернистых нефтей, газоконденсатов и установок аминной очистки нефтяных и природных газов, обычно используют на НПЗ для производства элементной серы, иногда для производства серной кислоты.
Наиболее распространенным и эффективным промышленным методом получения серы является процесс каталитической окислительной конверсии сероводорода Клауса.
Процесс Клауса осуществляется в две стадии:
1) стадия термического окисления сероводорода до диоксида серы
2)стадия каталитического превращения сероводорода и диоксида серы
По реакции 1 расходуется до 70 % масс, сероводорода и при этом выделяется значительное количество тепла, которое перед каталитической стадией должно быть утилизировано. Тепло, выделяющееся по реакции 2 (1/5 от всего тепла), позволяет вести каталитический процесс при достаточно низких температурах и большой объемной скорости без системы съема тепла.
Процесс термического окисления H2S осуществляют в основной топке, смонтированной в одном агрегате с котлом-утилизатором. Объем воздуха, поступающего в зону горения, должен быть строго дозирован, чтобы обеспечить для второй стадии требуемое соотношение SO2 и H2S (по стехиометрии реакции 2 оно должно быть 1:2). Температура продуктов сгорания при этом достигает 1100-1300°С в зависимости от концентрации H2S и углеводородов в газе.
Вывод серы из реакционной системы, образовавшейся при реакции 2, благоприятствует увеличению степени конверсии H2S до 95%. Поэтому стадию каталитической конверсии принято проводить в две ступени с выводом серы на каждой ступени.
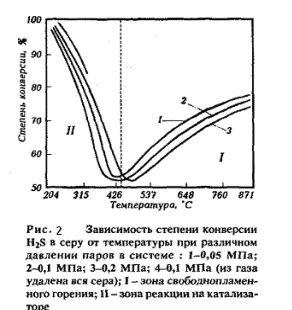
Зависимость степени конверсии H2S в серу от температуры и давления на обеих стадиях представлена на рис. 9.4. На графике показаны две зоны, разделенные пунктиром: высокотемпературная термического окисления (870-426 °С) и низкотемпературная каталитическая (426-204 °С).
В высокотемпературной зоне с повышением давления степень превращения H2S в серу снижается. В каталитической зоне повышение давления, наоборот, ведет к увеличению степени конверсии, так как давление способствует конденсации элементной серы и более полному выводу из зоны реакции.
Элементная сера существует в различных модификациях — S2, S6 и S8: при высоких температурах газообразная сера в основном состоит из S2, а при снижении температуры она переходит в S6, затем в S8. Жидкая сера представлена преимущественно модификацией S8.
На практике увеличение степени конверсии H2S достигается применением двух или более реакторов-конверторов с удалением серы конденсацией и последующим подогревом газа между ступенями. При переходе от одного реактора к другому по потоку газа температуру процесса снижают.
Традиционным катализатором в процессах Клауса вначале являлся боксит. На современных установках преимущественно применяют более активные и термостабильные катализаторы на основе из оксида алюминия.
Технологическая схема установки производства серы по методу Клауса
Продукты термической конверсии H2S из печи-реактора П-1 проходят котел-утилизатор Т-1, где они охлаждаются до =160°С (при которой жидкая сера имеет вязкость, близкую к минимальной). Сконденсированная сера поступает через гидрозатвор в подземный сборник серы. В Т-1 генерируется водяной пар с давлением 0,4 — 0,5 МПа, используемый в пароспутниках серопроводов. Далее в реакторах Р-I и Р-2 осуществляется двухступенчатая каталитическая конверсия Н2S и SO2 с межступенчатым нагревом газов в печах П-2 и П-3 и утилизацией тепла процесса после каждой ступени в котлах-утилизаторах Т-2 иТ-3. Сконденсированная в Т-2 и Т-3 сера направляется в сборник серы.
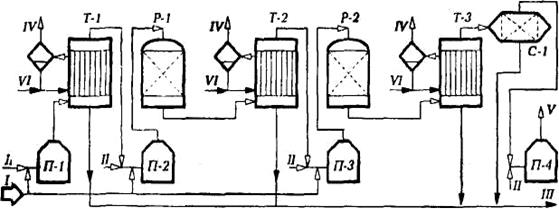 |
Рис. 3. Принципиальная технологическая схема установки получения серы из сероводорода по методу Клауса: I — сероводород; II — воздух; III — сера; IV — водяной пар; V — газы дожила; VI — конденсат
Газы каталитической конверсии второй ступени после охлаждения в котле-утилизаторе Т-3 поступают в сепаратор-скруббер со слоем насадки из керамических колец С-1, в котором освобождаются от механически унесенных капель серы.
Газы каталитической конверсии второй ступени после охлаждения в котле-утилизаторе Т-3 поступают в сепаратор-скруббер со слоем насадки из керамических колец С-1, в котором освобождаются от механически унесенных капель серы.
Технологический режим установки
Давление избыточное, МПа 0,03-0,05
Температура газа, °С
в печи-реакторе П-1 1100-1300
на выходе из котлов-утилизаторов 140-165
на входе в Р-1 260-270
на выходе из Р-1 290-310
на входе в Р-2 225-235
на выходе из Р-2 240-250
в сепараторе С-1 150
Сера широко применяется в народном хозяйстве — в производстве серной кислоты, красителей, спичек, в качестве вулканизирующего агента в резиновой промышленности и др.
Дата добавления: 2015-08-11 ; просмотров: 4339 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://prosto-o-slognom.ru/chimia_ovr/zadachi_02_H2S.html
http://helpiks.org/4-73274.html