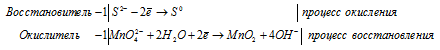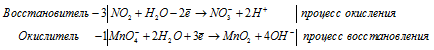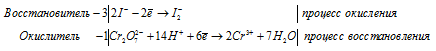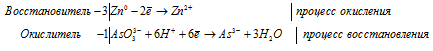Примеры решения задач. Закончите уравнение реакции и подберите коэффициенты методом электронного баланса: KI + KMnO4 + H2SO4 = I2 + .
Пример 1.
Закончите уравнение реакции и подберите коэффициенты методом электронного баланса: KI + KMnO4 + H2SO4 = I2 + ….
1. Дописываем уравнение реакции:
2. Определяем степени окисления в реагентах и продуктах, находим элементы, которые изменили свои степени окисления:
3. Составляем уравнения электронного баланса:
2I -1 – 2e ® I2 ï 5 восстановитель, окисление;
Mn +7 + 5e ® Mn +2 ï 2 окислитель, восстановление.
4. Проставляем коэффициенты с учетом множителей:
5. Подбирают коэффициенты для остальных участников реакции:
Пример 2.
Закончите уравнение реакции, подберите коэффициенты методом электронно-ионного баланса, и рассчитайте эквивалентую массу окислителя: NaCrO2 + NaOH + H2O2 → ….
3) Составим частные электронно-ионные уравнения /полуреакции/:
Для процесса окисления хромата натрия:
б/ CrO2 — + 4OH → CrO 2- 4 + 2H2O, /подведение баланса вещества/
в/ CrO2 — + 4OH — — 3е → CrO 2- 4 + 2H2O. /соблюдение равенства зарядов/
Для процесса восстановления пероксида водорода:
4) Подведем баланс зарядов и выведем коэффициенты:
CrО — 2 + 4OH — — 3е → CrO4 2- + 2H2O, окисление │2;
H2O2 + 2е → ОН — , восстановление │3.
5) Суммируем частные уравнения реакций окисления и восстановления после умножения на соответствующие коэффициенты:
6) Приведение подобных членов и сокращение:
(в данном случае сокращение не требуется)
7) Записываем уравнение реакции в молекулярном виде с учетом полученных коэффициентов:
8) Проверяем баланс по элементам в молекулярном уравнении. В данном случае никаких уточнений не требуется.
9) Рассчитаем молярную массу эквивалента окислителя, в данном случае пероксида водорода:
Э = М/z, где М – молярная масса Н2О2, равная 34 г/моль, z – число переносимых электронов.
Пример 3.
Напишите уравнения реакций между перманганатом калия и сульфитом калия в кислой, щелочной и нейтральной средах. Уравняйте методом электронно-ионного баланса.
MnO4 — + 8H + + 5е → Mn 2+ + 4H2O, восстановление | 2
SO3 2- + H2O – 2е → SO4 2- + 2H + , окисление | 5
б) Щелочная среда
MnO4 — + е → MnO4 2- , восстановление | 2
SO3 2- + 2OH — — 2е → SO4 2- + H2O, окисление | 1
в) Нейтральная среда
MnO4 — + 2H2O + 3е → MnO2 + 4OH — , восстановление | 2
SO3 2- + 2OH — — 2е → SO4 2- + 2H2O, окисление | 3
Пример 4.
В каком направлении в стандартных условиях будет протекать реакция: КСl + Br2 = KBr + Cl2? j (Br2 0 /2Br — ) = +1,09В, j (Cl2 0 /2Cl — ) = +1,36В.
Решение: Для определения направления реакции рассчитаем ее ЭДС. Для этого определим, что является окислителем, а что является восстановителем:
КСl -1 + Br2 0 = KBr -1 + Cl2 0 ; Сl -1 – отдает свои электроны, следовательно, является восстановителем, Br2 – окислителем.
ЭДС рассчитываем по формуле: ∆E 0 = j 0 ок-ля – j 0 вос-ля = 1,36 – 1,09 = 0,28 > 0. Т.к. ЭДС реакции больше нуля, то она протекает самопроизвольно в прямом направлении.
Ответ: реакция протекает самопроизвольно в прямом направлении.
Пример 5.
Рассчитайте молярную концентрацию нитрита натрия, если на титрование 20 мл его раствора, пошло 12,5 мл 0,01 М раствора дихромата калия в кислой среде.
Для расчета нормальной концентрации дихромата калия запишем уравнение протекающей реакции и уравнения полуреакций:
2Cr +6 + 6e ® 2Cr +3
Рассчитаем нормальную концентрацию K2Cr2O7:
где z – число переносимых электронов.
Найдем концентрацию нитрата натрия по закону эквивалентов:

Перейдем к молярной концентрации нитрата натрия по формуле:
СМ = СN / z = 0,0375/2 = 0,01875 моль/л.
Ответ: 0,01875 моль/л.
Дата добавления: 2016-01-09 ; просмотров: 6334 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Используя метод электронного баланса, составьте уравнение реакции: KI + … + H2SO4 → I2 + MnSO4 + … + H2O Определите окислитель и восстановитель.
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,297
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,223
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Составление уравнений в ионно-молекулярной форме
S 2 — + MnO4 2- + 2H2O = MnO2 + S 0 + 4OH —
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
4K + + S 2- + MnO4 2- + 2H2O = S + MnO2 + 4K + + 4OH — .
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Для уравнивания добавим в уравнение 1 моль K2SO4, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
3Zn 0 + AsO3 3- + 6H + = 3Zn 2+ + As 3- + 3H2O.
После приведения членов обеих частей уравнения, получим:
http://www.soloby.ru/487088/%D0%B8%D1%81%D0%BF%D0%BE%D0%BB%D1%8C%D0%B7%D1%83%D1%8F-%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D0%BD%D0%BE%D0%B3%D0%BE-%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B8%D1%82%D0%B5-%D0%BE%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C-%D0%B2%D0%BE%D1%81%D1%81%D1%82%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%82%D0%B5%D0%BB%D1%8C
http://buzani.ru/zadachi/khimiya-glinka/1213-uravneniya-v-ionno-molekulyarnoj-forme-zadachi-631-632