Тест 200
К какому классу соединений относится тирозин
Качественной реакцией на спирты является реакция с:
Укажите, какие из перечисленных соединений относятся к поверхностно-активным веществам:
1) циклические углеводороды
2) кислотные оксиды
3) слабые минеральные кислоты
4) желчные кислоты
1) ангидриды карбоновых кислот
2) сложные эфиры высших карбоновых кислот
3) соли карбоновых кислот
4) циклические углеводороды
Карбоновой кислотой является вещество, формула которого имеет вид:
6. Уреиды – это функциональные производные карбоновых кислот, содержащие остаток:
Растворы глицерина и этанола можно различить действием реагента:
Этанол является веществом, формула которого имеет вид:
При химическом взаимодействии глицерина с Cu ( OH )2 цвет раствора изменяется на:
В молекулах алкенов двойная связь между атомами углерода включает:
1) одну ионную и одну ковалентную связи
4) одну σ- и одну π-связи
Уравнение реакции, которая в водном растворе протекает практически до конца, имеет вид:
1) CaCl2 + 2NaNO3 = Ca(NO3)2 + 2NaCl
2) FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
3) BaSO4 + 2HCl = BaCl2 + H2SO4
4) K2SO4 + 2HCl = H2SO4 + 2KCl
Формула вещества с молекулярной кристаллической решеткой имеет вид:
Формула водородного соединения элемента, образующего высший оксид Э2О5:
14. Формула водородного соединения элемента, образующего высший оксид Э2О7:
15. Формула соли, водный раствор которой проявляет щелочную реакцию:
16. Восстановителем в реакции Fe + HNO 3→ Fe ( NO 3)3+ NO 2+ H 20 является:
Частицы малорастворимого вещества образуют _____ мицеллы:
1) поверхностный слой
2) адсорбционный слой
Для смещения равновесия в системе
CaCO 3(тв) CaO (тв) + CO 2(г); ∆ H ° > 0 в сторону продуктов реакции необходимо:
Чему равен температурный коэффициент реакции, если при увеличении температуры с 20 до 30 °С скорость ее увеличилась в 3 раза:
Энтальпия образования H 2 S (г) равна — 21 кДж/моль. При взаимодействии 16 г серы и 11,2 л водорода выделяется ___ кДж теплоты.
Нейтрализация электрического заряда и удаление гидратной оболочки коллоидных частиц:
22. Массовая доля соли в растворе, полученном при смешении 150 г 2%-ного и 350 г 4%-ного растворов, составляет:
23. С кислотами и щелочами взаимодействует оксид…
Раствор, содержащий 11,6 г вещества в 400г воды, замерзает при температуре -0,93°С (КН2О=1,86град кг/моль).Молярная масса растворенного вещества равна ____г/моль
Среди приведенных веществ дисперсной системой является…
1) раствор сахара
2) минеральная вода
3) соленый раствор
Формула высшего оксида элемента, образующего водородное соединение ЭН2:
Смешали 200г 20%-ного и 300г 10%-ного растворов глюкозы. Массовая доля вещества в полученном растворе равна в %:
28. Как называется зависимость адсорбции от концентрации при Т = const ?
При растворении в воде поверхностно-активного вещества величина поверхностного натяжения
1) сначала увеличивается, затем уменьшается
3) не изменяется
Если температурный коэффициент химической реакции равен 2, то при повышении температуры от 20°С до 50°С скорость реакции…
1) увеличивается в 6 раз
2) уменьшается в 4 раза
3) уменьшается в 2 раза
Пропущенными веществами в схеме химической реакции
Cl 2 + . → KClO 3 + . + H 2 O являются:
Пропущенными веществами в химической реакции CO 2 + . + Na 2 CO 3 = . являются:
Радиус атомов элементов возрастает в ряду:
1) Mg , Ca , Ba , Sr
4) Na , Rb , K , Se
Радиус атомов элементов возрастает в ряду:
В молекуле сероводорода _____ химическая связь:
3) ковалентная неполярная
4) ковалентная полярная
Раствор, содержащий 18 г глюкозы в 100 г воды (Кводы=1,86 град∙кг/моль), будет замерзать при ___ °С.
Растворы щелочей реагируют с:
Реакция, идущая до конца, описывается уравнением:
1) 2NaOH + K2SO4 = Na2SO4 + 2KOH
2) Cu(NO3)2 + 2KCl = CuCl2 + 2KNO3
3) FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
4) FeCl2 + K2SO4 = FeSO4 + 2KC
Реакция протекает до конца:
1) BaCl2 + 2KNO3 = Ba(NO3)2 + 2KCl
2) 3KOH + FeCl3 = Fe(OH)3 + 2KCl
3) CuCl2 + H2SO4 = CuSO4 + 2HCl
4) NaOH + KCl = KOH +NaCl
С увеличением заряда иона его коагулирующая способность:
3) не изменяется
4) уменьшается в 3-3,5 раза
С увеличением энергии взаимодействия между частицами, удельная поверхностная энергия:
1) не изменяется
2) резко уменьшается
4) изменяется неоднозначно
Гетерогенная система, состоящая из двух и более фаз с сильно развитой поверхностью раздела, называется:
Световой поток при прохождении через коллоидный раствор подвергается:
3) дифракционному рассеянию
Способ очистки золей, основанный на прохождении низкомолекулярных веществ через мембрану называется:
Сумма коэффициентов в уравнении реакции KOH + Cl 2 + t ° = KCl + KClO 3 + H 2 O равна:
Только ковалентный полярный тип химической связи имеют вещества:
1) PF5, Cl2O7, NH4Cl
2) F2, H2SO4, P2O5
3) H3PO4, BF3, CH3COONH4
4) NO2, SOCl2, CH3COOH
Увеличение скорости химической реакции в присутствии катализатора возникает в результате:
1) уменьшения константы скорости реакции
2) уменьшения энергии активности
3) увеличения константы равновесия
4) уменьшения константы равновесия
Увеличение скорости химической реакции при введении катализатора происходит в результате уменьшения:
1) скорости движения частиц
2) энергии столкновения
3) теплового эффекта
Уравнение Росм = CRT (закон Вант-Гоффа), характеризующее зависимость осмотического давления от концентрации и температуры, применимо:
1) к любым растворам
2) к растворам слабых электролитов
3) только к растворам неэлектролитов
4) только к растворам сильных электролитов
Уравнение процесса, протекающего на аноде при электролизе водного раствора бромида калия с инертными электродами, имеет вид:
1) 2H2O – 4e = O2 + 4H+
2) 4OH — — 4e = O2 + 2H2O
3) 2 H 2 O + 2 e = H 2 + 2 OH —
4) увеличивается в 8 раз
Приведенные схемы реакций
а ) Na2 ЭО 4 + H2SO4 → Na2 Э 2 О 7 + Na2SO4 + H2O
б ) Na2 Э 2 О 7 + H2SO4( конц ) → ЭО 3 + Na2SO4 + H2O
характерны для соединений элемента:
В 2 л 10%-ного раствора фосфорной кислоты (р=1,05 г/мл) содержится ___ граммов растворенного вещества.
В 400 мл 0,2М раствора нитрата натрия содержится ___ граммов соли.
В водном растворе невозможна реакция:
Радиус атомов элементов уменьшается в ряду:
В периоде с увеличением порядкового номера элементов металлические свойства:
1) изменяются неоднозначно
4) не изменяются
В узлах кристаллической решетки хлорида кальция находятся:
1) атомы Ca и молекулы Cl 2
2) молекулы CaCl 2
3) атомы Ca и Cl
В цепочке превращений Cu ( NO 3)2 → X → CuSO 4 промежуточным веществом Х является:
Вещество, в молекуле которого содержатся 2σ- и 2π-связи, имеет формулу:
Водородное соединение элемента в оксиде Э2О7 имеет формулу:
Восстановителем в реакции Ag + HNO 3 = AgNO 3 + NO 2 + H 2 O является:
Восстановительные свойства SO 2 проявляются в реакции:
Величина поверхностного натяжения при добавлении ПАВ:
2) не изменяется
4) увеличивается неоднозначно
Веществом с молекулярной кристаллической решеткой является:
Все вещества реагируют между собой в группе:
1) KOH , Ca ( OH )2, Fe ( OH )3
4) BaO , MgO , CuO
С уменьшением заряда ионов их коагулирующая способность:
1) изменяется неоднозначно
4) не изменяется
Гидролиз по аниону протекает в реакции:
4) Cu ( NO 3)2 + H 2 O =
Гидролизу по катиону подвергается соль, формула которой:
Движение частиц дисперсной фазы в дисперсионной среде коллоидного раствора называется:
Для защиты железных изделий от коррозии в качестве катодного покрытия используется:
Для золя гидроксида железа, полученного гидролизом его хлорида, потенциалопределяющим является ион:
Для золя йодида серебра, полученного по реакции AgNO 3 + KI (изб) → AgI ↓ + KNO 3, наилучшим коагулирующим действием будет обладать ион:
Для получения 1132 кДж тепла по реакции 2 NO (г) + O 2(г) 2 NO 2(г);
(∆ H ° = -566 кДж) необходимо затратить ___ литра(ов) кислорода.
Для получения сероводорода в лаборатории используется реакция:
Для смещения равновесия в сторону продуктов реакции N 2 + H 2 = NH 3; ∆ H NH 3
4) уменьшить концентрацию N 2 и H 2
∆ H ° Fe + Cl 2 → X 1 + NaOH → X 2 + t ° → X 3 конечным веществом X 3 является:
Для цепочки превращений Fe + O 2 + H 2 O → X 1 + t ° → X 2 + Al t ° → X 3 конечным веществом X 3 является:
Для цепочки превращений Fe ( OH )2 + Н Cl → X 1 + NaOH → X 2 + t ° → X 3 конечным веществом X 3 является:
Закон Вант-Гоффа ( Р=С RT ) применим для:
1) любых растворов
2) слабых растворов
3) сильных растворов
4) растворов неэлектролитов
Какая из перечисленных реакций приводит к образованию золя:
Коллоидные системы, в которых растворитель (вода) не взаимодействуют с ядрами коллоидных частиц, называются:
Для цепочки превращений Cu + HNO 3 → X 1 + NaOH → X 2 + t ° → X 3 конечным веществом X 3 является:
Если при увеличении температуры от 20 °С до 50 °С скорость реакции увеличилась в 8 раз, то температурный коэффициент равен:
Зависимость величины адсорбции от равновесной концентрации или парциального давления при постоянной температуре называется _____ адсорбции.
Закон, выражающий влияние концентраций реагирующих веществ на скорость химической реакции, называется законом:
4) действующих масс
Нейтрализация электрического заряда и удаление гидратной оболочки коллоидных частиц:
Заряд золя, полученного по химической реакции избытка серной кислоты и хлорида бария имеет знак:
3) не имеет заряда
4) частично положительный
К числу наиболее вредных для организма человека относятся следующие металлы:
По теории строения коллоидных растворов, мицелла является частицей:
2) положительно заряженной
4) отрицательно заряженной
Если энтальпия образования SO 2 равна-297 кДж/моль, то количество теплоты, выделяемое при сгорании 16 г серы, равно____кДж.
При реакции оксида серы ( IV ) с избытком раствора NaOH образуется…
1) гидросульфит натрия
2) гидросульфат натрия
3) сульфит натрия и вода
4) сульфат натрия и вода
Уравнение реакции, практически осуществимой в водном растворе:
1) Ba(NO3)2 +2NaOH =2NaNO3 +Ba(OH)2
2) NaNO3 +HCl =NaCl + HNO3
3) CuSO4 +2KOH =K2SO4 +Cu(OH)2
4) Fe2(SO4)3 +6HNO3 =2Fe(NO3)3 +3H2SO4
С увеличением длины углеводородного радикала поверхностная активность карбоновых кислот:
3) изменяется неоднозначно
4) не изменяется
Кислотный характер имеют оксиды, образованные металлами:
1) со степенью окисления ниже +4
2) со степенью окисления равной или выше +4
3) с любой степенью окисления
4)г лавных подгрупп
Согласно теории строения коллоидных растворов, мицелла состоит из:
1) ядра и диффузного слоя
2) ядра и адсорбционного слоя
3) адсорбционного и диффузного слоев
4) гранулы и диффузного слоя
Если энтальпия образования CO2 равна — 393 кДж/ моль, тогда количество теплоты, выделяемое при сгорании 24 г. углерода, равно:
Физиологическим раствором является:
1) 2% раствор глюкозы
2) 0.9% раствор хлорида натрия
3) 1.2% раствор сульфата магния
4) 9% раствор
Какая соль при гидролизе дает щелочную реакцию среды:
Коагулирующее действие на золь, полученный по реакции
AgNO 3 + NaCl (изб) = AgCl + NaNO 3, будут оказывать:
1) нейтральные молекулы
2) анионы электролита
3) катионы электролита
4) катионы и анионы одновременно
Коллоидная частица, полученная при взаимодействии избытка раствора хлорида бария с раствором серной кислоты:
1) не имеет заряда
2) заряжена отрицательно
3) заряжена положительно
4) имеет частичный отрицательный заряд
Коллоидная частица, полученная при взаимодействии раствора хлорида бария с избытком серной кислоты:
1) не имеет заряда
2) заряжена отрицательно
3) заряжена положительно
4) имеет частичный положительный заряд
Частицы нерастворимого вещества образуют:
1) адсорбционный слой
3) диффузный слой
4) двойной электрический слой
Концентрация раствора этиленгликоля (тосол), замерзающего при -37,2°С (Кн2о=1,86град∙кг/моль), составляет ___ моль/кг.
Кислотный характер имеют оксиды металлов со степенью окисления:
1) со степенью окисления ниже +4
2) со степенью окисления равной или выше +4
3) с любой степенью окисления
4) главных подгрупп
Разрыв эритроцитарных оболочек вследствие осмотического проникновения жидкости называется:
Масса воды, необходимая для приготовления 400 г 20%-ного раствора нитрата калия, равна _____ граммам:
Метод получения коллоидных систем, основанный на физическом дроблении крупных частиц, называется:
Наиболее сильной кислотой является:
Минимальный запас энергии частиц в момент столкновения, необходимый для протекания химической реакции, называется:
1) энергией активации
2) энтальпией реакции
3) энергией ионизации
4) тепловым эффектом
Молярная концентрация 1л 36,5%-ного раствора Н Cl (р=1,18г/мл) равна:
Наиболее прочная химическая связь является в молекуле:
Метод разделения, основанный на проникновении молекул и ионов через мембрану, не проницаемую для коллоидных частиц, называется:
Образование коллоидного раствора возможно в реакции:
1) KOH + H 2 SO 4 →
Образование осадка наблюдается при сливании растворов:
Окислителем в реакции
KMnO 4 + KNO 2 + H 2 SO 4 = K 2 SO 4 + MnSO 4 + KNO 3 + H 2 O является:
Окислителем в реакции
KMnO4 + Na2SO3 + H2SO4 = K2SO4 + Na2SO4 + MnSO4 + H2O является :
Окислительные свойства оксида серы ( IV ) проявляются в реакции:
2) SO2 + KMnO4 + H2O =
Оксид-иону соответствует следующая электронная конфигурация:
1) 1 s 2 2 s 2 2 p 2
2) 1 s 2 2 s 2 2 p 3
3) 1 s 2 2 s 2 2 p 4
Оксиды образуются при:
1) растворении хлора в воде
2) растворении негашеной извести
3) горении железа в хлоре
4) горении природного газа
Осмотическое давление 0,5 М раствора этанола при 20 °С равно ___ кПа.
Отношение числа молекул, диссоциирующих на ионы, к общему числу молекул называется _______ диссоциации.
Поверхностно-активным является вещество, формула которого имеет вид:
125. С увеличением температуры адсорбция:
3) не изменяется
4) возрастает, а затем уменьшается
1) неорганических оксидов
2) минеральных кислот
3) неорганических солей
4) солей высших карбоновых кислот
При разложении нитрата серебра образуется:
2) Ag2O + N2O5 + O2
4) Ag 2 O + N 2 O 5
При увеличении давления в 3 раза, скорость химической реакции O 2 + 2 H 2 = 2 H 2 O увеличивается в:
При увеличении давления в 5 раз скорость прямой химической реакции
1) не изменяется
2) увеличивается в 15 раз
3) увеличивается в 25 раз
4) увеличивается в 10 раз
При электролизе водного раствора KBr на аноде идет процесс окисления:
1) 2H2O + O2 + 4e = 4OH-
3) 2Br — — 2e = Br2
4) 2 KBr – 2 e = 2 K + + Br 2
Промышленному получению сероводорода соответствует химическая реакция:
1) 2HCl + FeS = FeCl2 + H2S
2) Al2S3 + H2O = 2Al(OH)3 + H2S
4) S +2 НI = Н2S + I2
Пропущенными веществами в схеме химической реакции H 2 S + . = H 2 O + . являются:
Пропущенными веществами в схеме химической реакции
Al + . = . + NH4NO3 + H2O являются :
Пропущенны e вещества в схеме химической реакции CaH 2 + . = Ca ( OH )2 + .
Аминокислоты, в отличие от аминов взаимодействуют с:
Невозможно протекание реакции:
Ароматические УВ, в отличие от алкенов, вступают в реакции:
В реакции горения аминов в избытке кислорода образуется:
2) N2, CO, CO2, H2O
Для алканов характерны реакции:
При взаимодействии оксида углерода (IV) с избытком KOH образуется:
1) гидрокарбонат калия
2) карбонат калия
3) карбонат калия и вода
4) гидрокарбонат калия и вода
BaH 2+ H 2 O → Ba ( OH )2 +. Пропущенное вещество в схеме реакции:
Укажите, молекулы каких соединений из приведенного ряда способны ассоциироваться за счет водородных связей:
1) CCl4, CH4, CaF2
2) CHCl3, H2CO3, NaOH
3) H2O, HF, C2H5OH
4) CH4, CaF2, H2CO3
Формула высшего оксида элемента, образующего водородное соединение ЭН3 имеет вид:
рН крови в норме:
Соотношение компонентов бикарбонатной буферной системы в крови в норме составляет:
При повышении температуры от 50°С до 70°С и значении температурного коэффициента 3 скорость химической реакции увеличится в:
147. Альбумин с р I = 4.75 находится в буферном растворе с рН = 6.37 . Каково направление движения белка при электрофорезе:
3) остается на старте
4) сначала к аноду, затем к катоду
3) истинный раствор
149. Явление увеличения кислотности физиологических сред в сравнении с нормой называется:
Название комплексного соединения «Тетрацианокупрат (II) калия»
1) K 4 [ Fe ( CN )6]
2 мл 3% раствора преднизолона (пл=1) содержат чистого преднизолона:
Только сильные электролиты приведены в ряду:
1) NaOH H2S Ca(OH)2
3) H2CO3 H2SiO3 Fe(OH)3
4) NaOH H3PO4 H2SO4
Хлороводород массой 20г растворили в 180 г воды. Массовая доля вещества в полученном растворе равна:
Высший оксид элемента, которому соответствуют гидратные формы H 4Э2 O 7 и НЭО3:
Шкала рН изменяется в пределах:
Поверхностно-активными веществами являются:
2) H2SO4, HCl, HNO3
4) NaOH , KOH , Cu ( OH )2
С кислотами и щелочами взаимодействует:
Аминокислоты, в отличие от аминов взаимодействуют с:
В 100 мл водного раствора содержится 36,5 г HCl . Молярная концентрация раствора равна:
Кислотным оксидом является:
2) оксид меди( II )
3) оксид железа( II )
При взаимодействии избытка сероводорода с гидроксидом калия образуется…
1) сульфат калия
2) гидросульфат калия и вода
3) гидросульфид калия и вода
4) гидросульфит калия
К 100 г 5% NaCl добавили 150 г воды. Массовая доля вещества в растворе составляет:
При получении 2 моль этанола согласно термохимической реакции
С2Н4(г)+Н2О(г)→С2Н5ОН(ж) ∆Н0=-44кДж выделяется_____ кДж теплоты:
Смешали 400г 10% и 100г 5% растворов глюкозы. Массовая доля вещества в полученном растворе равна:
Сколько изомеров имеет спирт, общей формулы C 3 H 7 OH :
Следующие вещества образуются при горении аминов в избытке кислорода:
Химические реакции непредельных углеводородов с галогенводородами происходят по правилу:
Число спиртов, отвечающих формуле C 3 H 7 OH равно:
Метиловый эфир пропионовой кислоты можно получить реакцией этерификации между:
1) C2H5OH + CH3COOH
2) C3H7OH + CH3COOH
3) CH3OH + CH3CH2COOH
4) CH3OH + CH3COOH
В реакции присоединения избытка брома к ацетилену образуется…
Этаналь является веществом, формула которого имеет вид:
Для непредельных УВ характерны следующие виды изомерии:
Дегидратацией этанола при температуре выше 150 °С получают:
К какому классу соединений относится аланилсерин
Образование соли происходит при взаимодействии метиламина с:
1) гидроксидом натрия
4) соляной кислотой
Общая формула одноатомных предельных спиртов это:
Первичным амином является вещество, формула которого:
При взаимодействии ацетилена с H 2 O в присутствии катализатора образуется:
Бромную воду обесцвечивает:
3) пропановая кислота.
При взаимодействии хлорпропана с водным раствором щелочи образуется:
При гидрировании бутанона в присутствии катализатора образуется:
При гидрировании пропанона в присутствии катализатора образуется:
При замене в молекуле метиламина метильной группы на фенильную основные свойства:
1) не изменяются
3) увеличиваются незначительно
4) резко увеличиваются
В реакции присоединения избытка брома к бутину-1 образуется:
Признаком протекания реакции многоатомных спиртов с Cu ( OH )2 является образование:
1) темно-синего раствора
2) малинового раствора
3) красного осадка
4) бурого осадка
Присоединение галогенводородов к алкенам протекает по правилу:
Растворы глицерина и метанола можно отличить при действии:
Кетоны образуются при окислении:
1) первичных спиртов
2) вторичных спиртов
3) третичных спиртов
Реакции, протекающие под действием отрицательно заряженных частиц, называются:
190. Реакции, протекающие при действии положительно заряженных частиц, называются:
4) реакциями присоединения
Качественной реакцией на альдегиды является реакция, схема которой…
Реакции, протекающие под действием положительно заряженных частиц, называются…..
Для ароматических углеводородов, в отличие от алкенов, более характерны реакции:
При гидрировании пропанона в присутствии катализатора образуется:
Изомерия, обусловленная положением заместителей при двойной связи:
196. Раствор йода в присутствии йодида калия является качественной реакцией (синяя окраска) на:
При взаимодействии ацетилена с водой в присутствии солей ртути( II ) образуется:
4) этановая кислота
Реакция галогенирования алканов протекает по механизму:
1) нуклеофильного замещения
2) электрофильного замещения
3) радикального замещения
4) нуклеофильного присоединения
Реакция галогенирования бензола протекает по механизму:
1) нуклеофильного замещения
2) радикального замещения
3) электрофильного замещения
4) нуклеофильного присоединения
При гидрировании бутанона в присутствии катализатора образуется:
Реакции обмена в водных растворах электролитов. Ионные реакции и уравнения
Так как молекулы электролитов в растворах распадаются на ионы, то и реакции в растворах электролитов происходят между ионами.
Реакции, протекающие между ионами, называются ионными реакциями.
С участием ионов могут протекать как обменные, так и окислительно-восстановительные реакции. Рассмотрим реакции ионного обмена, например взаимодействие между растворами двух солей:
Это уравнение является молекулярным уравнением, так как формулы всех веществ записаны в виде молекул. Исходные вещества Na2SО4 и ВаCl2 являются сильными электролитами, т. е. в растворе находятся в виде ионов. Сульфат бария — нерастворимая соль, которая выпадает в осадок, следовательно, ионы Ва 2+ и SО4 2- уходят из раствора. Хлорид натрия NaCl — растворимая соль, сильный электролит, в растворе находится в виде ионов (Na + + Сl — ). Таким образом, с учетом диссоциации сильных электролитов уравнение реакции можно записать так:
Такое уравнение называется полным ионным уравнением.

Ионы Na + и Cl — имеются и в левой, и в правой частях уравнения, т. е. эти ионы в реакции участия не принимают, их можно исключить из уравнения:
Полученное уравнение называется сокращенным ионным уравнением. Оно показывает, что в ходе данной реакции происходит связывание ионов SO4 2- , которые находились в растворе NaSО4, и ионов Ва 2+ , которые находились в растворе ВаCl2, и в результате образовалась нерастворимая соль BaSО4.
Сокращенное ионное уравнение (3) выражает сущность не только реакции (1). Напишем уравнения нескольких реакций:
Как видим, сущность реакций (4) и (5), как и реакции (1), заключается в связывании ионов SO4 2- и Ва 2+ с образованием нерастворимой соли BaSО4.
В ионных уравнениях формулы веществ записывают в виде ионов или в виде молекул.
В виде ионов записывают формулы:
В виде молекул записывают формулы:
— малорастворимых солей(↓) AgCl, BaSO4, СаСО3, FeS и др.;
Большая часть молекул слабых электролитов в растворе не диссоциирует на ионы.
В виде молекул также записывают:
В уравнениях реакций ставят знак ↓, если среди продуктов реакции есть осадок — нерастворимые или малорастворимые вещества. Знак ↑ показывает газообразные и летучие соединения.
Реакции обмена в водных растворах электролитов могут быть:
1) практически необратимыми, т. е. протекать до конца;
2) обратимыми, т. е. протекать одновременно в двух противоположных направлениях.
1) Реакции обмена между сильными электролитами в растворах протекают до конца, или практически необратимы, когда ионы соединяются друг с другом и образуют:
а) малорастворимые вещества;
б) малодиссоциирующие вещества — слабые электролиты;
в) газообразные или летучие вещества.
Рассмотрим эти случаи.
а) Реакции с образованием малорастворимых веществ, выпадающих в осадок (↓).
Составим молекулярное и ионное уравнения реакции между нитратом серебра (I) AgNO3 и хлоридом натрия NaCl:
Эта реакция обмена необратима, потому что один из продуктов уходит из сферы реакции в виде нерастворимого вещества.
б) Реакции, идущие с образованием малодиссоциирующих веществ (слабых электролитов).
Составим молекулярное и ионное уравнения реакции нейтрализации между растворами гидроксида натрия NaOH и серной кислоты H2SO4:
или, сокращая коэффициенты, получим: ОН — + Н + = Н2О.
В результате реакции нейтрализации ионы водорода Н + и гидроксид-ионы ОН — образуют малодиссоциирующие молекулы воды. Процесс нейтрализации идет до конца, т. е. эта реакция необратима.
в) Реакции, протекающие с образованием газообразных веществ.
Составим молекулярное и ионное уравнения реакции между растворами гидроксида кальция и хлорида аммония NH4Cl:
Эта реакция обмена необратима, потому что образуются газ аммиак NH3 и малодиссоциирующее вещество вода.
2) Если среди исходных веществ имеются слабые электролиты или малорастворимые вещества, то такие реакции являются обратимыми, т. е. до конца не протекают. Например:
Если исходными веществами реакций обмена являются сильные электролиты, которые при взаимодействии не образуют малорастворимых или малодиссоциирующих веществ, то такие реакции не протекают. При смешивании их растворов образуется смесь ионов, которые не соединяются друг с другом. Например:
Уравнение реакции которая в водном растворе протекает практически
Уравнение 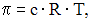
При электролизе 200 г расплава гидроксида натрия (выход по току составляет 100%) на инертном аноде образуется ____ л кислорода (н.у.).
Уравнение элементарной реакции, скорость которой при повышении давления в 3 раза увеличивается в 27 раз, имеет вид …
При электролизе раствора, содержащего равные количества ионов 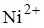
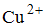
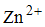
Уравнение реакции, скорость которой при стандартных условиях практически не зависит от изменения давления, имеет вид …
При электролизе водного раствора фторида натрия на инертном аноде протекает процесс, уравнение которого имеет вид …
Уравнение реакции, которая в водном растворе протекает практически до конца, имеет вид …
При электролизе водного раствора сульфата натрия на инертном аноде протекает процесс, уравнение которого имеет вид …
Уравнение реакции, в которой при увеличении давления равновесие смещается в сторону продуктов, имеет вид …
При электролизе водного раствора бромида калия на инертном катоде протекает процесс, уравнение которого имеет вид …
http://al-himik.ru/reakcii-obmena-v-vodnyh-rastvorah-jelektrolitov-ionnye-reakcii-i-uravnenija/
http://iexam.ucoz.org/publ/khimija/72-18













