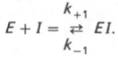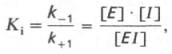БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ — Е. С. Северина — 2004
РАЗДЕЛ 2. ЭНЗИМОЛОГИЯ
VI. Ингибирование ферментативной активности
Под термином «ингибирование ферментативной активности» понимают снижение каталитической активности в присутствии определённых веществ — ингибиторов. К ингибиторам следует относить вещества, вызывающие снижение активности фермента. Следует отметить, что все денатурирующие агенты также вызывают уменьшение скорости любой ферментативной реакции, вследствие неспецифической денатурации белковой молекулы, поэтому денатурирующие агенты к ингибиторам не относят.
Ингибиторы вызывают большой интерес для выяснения механизмов ферментативного катализа, помогают установить роль отдельных ферментов в метаболических путях организма. В основе действия многих лекарственных препаратов и ядов лежит ингибирование активности ферментов, поэтому знание механизмов этого процесса крайне важно для молекулярной фармакологии и токсикологии.
Ингибиторы способны взаимодействовать с ферментами с разной степенью прочности. На основании этого различают обратимое и необратимое ингибирование. По механизму действия ингибиторы подразделяют на конкурентные и неконкурентные.
А. Обратимое ингибирование
Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определённых условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными.
1. Конкурентное ингибирование
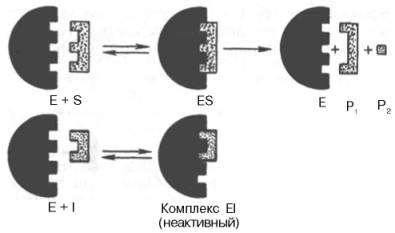
К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор — структурный аналог субстрата, в результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. В этом случае с ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат (ЕS) или фермент-ингибитор (ЕI). При формировании комплекса фермента и ингибитора (ЕI) продукт реакции не образуется (рис. 2-21).
Рис. 2-21. Схема конкурентного ингибирования активности фермента.
Для конкурентного типа ингибирования справедливы следующие уравнения:
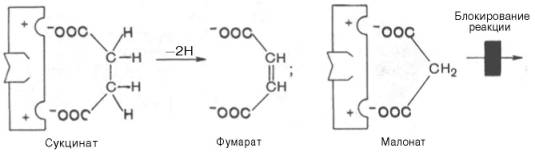
Классический пример конкурентного ингибирования — ингибирование сукцинатдегидрогеназной реакции малоновой кислотой (рис. 2-22). Малоновая кислота — структурный аналог сукцината (наличие двух карбоксильных групп) и может так же взаимодействовать с активным центром сукцинат дегидрогеназы. Однако отщепление двух атомов водорода от малоновой кислоты невозможно; следовательно, скорость реакции снижается.
Рис. 2-22. Пример конкурентного ингибирования сукцинат- дегидрогеназы малоновой кислотой. I — сукцинат связывается с активным центром фермента сукцинатдегидрогеназы; II — в ходе ферментативной реакции происходит отщепление двух атомов водорода от сукцината и присоединение их к коферменту FAD. В результате образуется фумарат, который высвобождается из активного центра сукцинатдегидрогеназы; III — малоновая кислота — структурный аналог сукцината, она также связывается с активным центром сукцинатдегидрогеназы. При этом химическая реакция не идёт.
Конкурентные ингибиторы уменьшают скорость химической реакции. Конкурентный ингибитор повышает Кm для данного субстрата (уменьшает сродство субстрата к ферменту). Это означает, что в присутствии конкурентного ингибитора необходима большая концентрация субстрата для достижения 1/2 Vmax.
Увеличение соотношения концентрации субстрата и ингибитора снижает степень ингибирования. При значительно более высоких концентрациях субстрата ингибирование полностью исчезает, потому что активные центры всех молекул фермента будут находиться преимущественно в комплексе с субстратом.
Лекарственные препараты как конкурентные ингибиторы
Многие лекарственные препараты оказывают своё терапевтическое действие по механизму конкурентного ингибирования. Например, четвертичные аммониевые основания ингибируют ацетилхолинэстеразу, катализирующую реакцию гидролиза ацетилхолина на холин и уксусную кислоту (см. схему ниже).
При добавлении ингибиторов активность ацетилхолинэстеразы уменьшается, концентрация ацетилхолина (субстрата) увеличивается, что сопровождается усилением проведения нервного импульса. Ингибиторы холинэстеразы используют при лечении мышечных дистрофий. Эффективные антихолинэстеразные препараты — прозерин, эндрофоний и др. (рис. 2-23).
Рис. 2-23. Схема активного центра ацетилхолинэстеразы. А — присоединение ацетилхолина в активном центре фермента. Стрелкой указано место гидролиза эфирной связи в молекуле ацетилхолина; Б — присоединение конкурентного ингибитора — прозерина в активном центре фермента. Указано место гидролиза прозерина, однако реакция идёт намного медленнее, чем с ацетилхолином; В — присоединение конкурентного ингибитора в активном центре фермента — эндрофония. Эндрофоний связывается в активном центре ацетилхолинэстеразы, препятствуя присоединению ацетилхолина.
Антиметаболиты как лекарственные препараты
В качестве ингибиторов ферментов по конкурентному механизму в медицинской практике используют вещества, называемые антиметаболитами. Эти соединения, будучи структурными аналогами природных субстратов, вызывают конкурентное ингибирование ферментов, с одной стороны, и, с другой — могут использоваться этими же ферментами в качестве псевдосубстратов, что приводит к синтезу аномальных продуктов. Аномальные продукты не обладают функциональной активностью; в результате наблюдают снижение скорости определённых метаболических путей.
В качестве лекарственных препаратов используют следующие антиметаболиты: сульфаниламидные препараты (аналоги парааминобензойной кислоты), применяемые для лечения инфекционных заболеваний (см. раздел 9), аналоги нуклеотидов для лечения онкологических заболеваний (см. раздел 10).
2. Неконкурентное ингибирование
Неконкурентным называют такое ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра (рис. 2-24). Неконкурентные ингибиторы не являются структурными аналогами субстрата.
Неконкурентный ингибитор может связываться либо с ферментом, либо с фермент-субстратным комплексом, образуя неактивный комплекс. Присоединение неконкурентного ингибитора вызывает изменение конформации молекулы фермента таким образом, что нарушается взаимодействие субстрата с активным центром фермента, что приводит к снижению скорости ферментативной реакции.
Рис. 2-24. Схема неконкурентного ингибирования активности фермента.
Кинетическая зависимость неконкурентного ингибирования представлена на рис. 2-25. Этот тип ингибирования характеризуется снижением Vmах ферментативной реакции и уменьшением сродства субстрата к ферменту, т. е. увеличением Кm.
Рис. 2-25. Влияние неконкурентного ингибитора на скорость ферментативной реакции в зависимости от концентрации субстрата. Vmах — максимальная скорость реакции в отсутствие ингибитора; ‘\/mах — максимальная скорость реакции в присутствии ингибитора; Кm — константа Михаэлиса в отсутствие ингибитора; ‘Кm — константа Михаэлиса в присутствии ингибитора.
Б. Необратимое ингибирование
Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента. В результате фермент не может выполнять каталитическую функцию.
К необратимым ингибиторам относят ионы тяжёлых металлов, например, ртути (Нg 2+ ), серебра (Аg + ) и мышьяка (Аs 3+ ), которые в малых концентрациях блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению (рис. 2-26). При наличии реактиваторов ферментативная функция восстанавливается. В больших концентрациях ионы тяжёлых металлов вызывают денатурацию белковой молекулы фермента, т. е. приводят к полной инактивации фермента.
Рис. 2-26. Механизм действия ионов ртути как необратимого ингибитора. Ионы ртути в малых концентрациях блокируют сульфгидрильные группы активного центра, что приводит к снижению скорости ферментативной реакции.
1. Специфические и неспецифические ингибиторы
Использование необратимых ингибиторов представляет большой интерес для выяснения механизма действия ферментов. С этой целью применяют вещества, блокирующие определённые группы активного центра ферментов. Такие ингибиторы называют специфическими. Ряд соединений легко вступает в реакции с определенными химическими группами. Если эти группы участвуют в катализе, то происходит полная инактивация фермента.
Роль гидроксильных групп серина в механизме катализа исследуют с помощью фторфосфатов, например, диизопропилфторфосфата. Диизопропилфторфосфат (ДФФ) специфически реагирует лишь с одним из многих остатков серина в активном центре фермента. Остаток Сер, способный реагировать с ДФФ, имеет идентичное или очень сходное аминокислотное окружение (табл. 2-2). Высокая реакционная способность этого остатка по сравнению с другими остатками Сер обусловлена аминокислотными остатками, также входящими в активный центр ферментов.
Таблица 2-2. Исследование последовательности аминокислотных остатков вокруг реакционноспособного остатка серина, взаимодействующего с ДФФ
Функция ферментов (подкласс ферментов)
Аминокислотные остатки, находящиеся в окружении реакционно-способного серина в активном центре
Активирование и ингибирование ферментов
Скорость ферментативной реакции, как и активность фермента, в значительной степени определяется также присутствием в среде активаторов и ингибиторов: первые повышают скорость реакции, а вторые тормозят эту реакцию. Активирующее влияние на скорость ферментативной реакции оказывают разнообразные вещества органической и неорганической природы. Так, соляная кислота активирует действие пепсина желудочного сока;
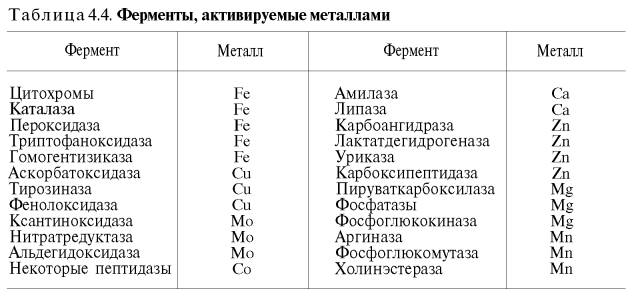
желчные кислоты повышают активность панкреатической липазы; некоторые тканевые ферменты (оксидоредуктазы, катепсины, аргиназа), растительная протеиназа и др. в значительной степени активируются соединениями, содержащими свободные SH-группы (глутатион, цистеин), а ряд ферментов – также витамином С. Особенно часто активаторами выступают ионы двухвалентных и, реже, одновалентных металлов. Получены доказательства, что около четверти всех известных ферментов для проявления полной каталитической активности нуждаются в присутствии металлов. Многие ферменты вообще не активны в отсутствие металлов. Так, при удалении цинка угольная ангидраза (карбоангидраза), катализирующая биосинтез и распад Н2СО3, практически теряет свою ферментативную активность; более того, цинк при этом не может быть заменен никаким другим металлом. Известны ферменты , действие которых активируется ионами нескольких металлов; в частности, енолаза активируется Mg 2+ , Mn 2+ , К + (табл. 4.4).
Молекулярный механизм действия металлов в энзиматическом катализе, или роль металлов в активировании ферментами. В ряде случаев ионы металлов (Со 2+ , Mg 2+ , Zn 2+ , Fe 2+ ) выполняют функции простетических групп ферментов, или служат акцепторами и донаторами электронов, или выступают в качестве электрофилов либо нуклеофилов, сохраняя реактивные группы в необходимой ориентации. В других случаях они способствуют присоединению субстрата к активному центру и образованию фермент-субстратного комплекса. Например, ионы Mg 2+ через отрицательно заряженную фосфатную группу обеспечивают присоединение монофосфатных эфиров органических веществ к активному центру фосфатаз, катализирующих гидролиз этих соединений. Иногда металл соединяется с субстратом, образуя истинный субстрат, на который действует фермент. В частности, ионы Mg 2+ активируют креатинфосфокиназу благодаря образованию истинного субстрата – магниевой соли АТФ. Наконец, имеются экспериментальные доказательства прямого участия металлов (например, ионов Са 2+ в молекуле амилазы слюны) в формировании и стабилизации активного центра и всей трехмерной структуры молекулы фермента. Следует отметить также, что металлы нередко выступают в роли аллостерических модуляторов (эффекторов; см. рис. 4.22). Взаимодействуя с аллостеричес-ким центром, подобный металл (эффектор) способствует образованию наиболее выгодной пространственной конфигурации фермента и активного фермент-субстратного комплекса.
Анионы в физиологических концентрациях обычно неэффективны или оказывают небольшое активирующее влияние на ферменты. Исключение составляют пепсин, некоторые оксидоредуктазы, активируемые анионами, а также амилаза слюны, катализирующая гидролиз крахмала, активность которой повышается при действии ионов хлора, и аденилатциклаза, которая активируется анионами галогенов.
Ингибиторы ферментов обычно принято делить на два больших класса: обратимые и необратимые. Это вещества, вызывающие частичное (обратимое) или полное торможение реакций, катализируемых ферментами. Недавно открыты антиферменты (антиэнзимы, или антизимы), представляющие собой белки (или полипептиды), действующие как ингибиторы ферментов. К подобным веществам относятся, например, ингибитор трипсина, обнаруженный в соевых бобах, и сывороточный антитрипсин. Недавно открыт в печени животных антифермент орнитинде-карбоксилазы (см. главу 12). Антизимы, вероятнее всего, образуют трудно-диссоциируемые комплексы с соответствующими ферментами, выключая их из химических реакций. Иногда ингибитор является составным компонентом предшественника фермента, например пепсина (см. главу 12), или входит в состав сложных комплексов ферментов, например в состав протеинкиназы и протеинфосфатазы, катализирующих процессы фосфо-рилирования-дефосфорилирования в живых организмах. Однако до сих пор не выяснено, являются ли подобные антиферменты истинными ингибиторами или регуляторными субъединицами, в частности, какова разница в назначении регуляторной (R) субъединицы в составе протеинкиназы и ингибиторной (I) субъединицы в составе протеинфосфатазы.
Ферменты являются белками, поэтому любые агенты, вызывающие денатурацию белка (кислоты, щелочи, соли тяжелых металлов, нагревание), приводят к необратимой инактивации фермента. Однако подобное инак-тивирование относительно неспецифично, оно не связано с механизмом действия ферментов. Гораздо большую группу составляют так называемые специфические ингибиторы, которые оказывают свое действие на какой-либо один фермент или группу родственных ферментов, вызывая обратимое или необратимое ингибирование. Исследование этих ингибиторов имеет важное значение. Во-первых, ингибиторы могут дать ценную информацию о химической природе активного центра фермента, а также о составе его функциональных групп и природе химических связей, обеспечивающих образование фермент-субстратного комплекса. Известны вещества, включая лекарственные препараты, специфически связывающие ту или иную функциональную группу в молекуле фермента, выключая ее из химической реакции. Так, йодацетат IСН2—СООН, его амид и этиловый эфир, пара-хлормеркурибензоат ClHg—С6Н4—СООН и другие реагенты сравнительно легко вступают в химическую связь с некоторыми SH-группами ферментов. Если такие группы имеют существенное значение для акта катализа, то добавление подобных ингибиторов приводит к полной потере активности фермента:
Действие ряда других ферментов (холинэстераза, трипсин и химотрип-син) сильно тормозится некоторыми фосфорорганическими соединениями, например ДФФ, вследствие блокирования ключевой гидроксильной группы серина в активном центре (см. ранее).
Во-вторых, ингибиторы нашли широкое применение в энзимологии при исследовании природы множественных форм ферментов и изоферментов, различающихся не столько электрофоретической подвижностью, сколько различной чувствительностью к одному и тому же ингибитору.
При помощи ингибиторов, выключающих отдельные стадии многоступенчатого метаболического процесса, могут быть точно установлены не только последовательность химических реакций, но и природа участвующих в этих превращениях ферментов. Этим путем, применяя йодацетат, фториды и другие специфические ингибиторы, был расшифрован глико-литический путь окислительно-восстановительных превращений глюкозы до стадии образования молочной кислоты в мышечной ткани, насчитывающий 11 стадий с участием 11 ферментов и 10 промежуточных метаболитов.
С ингибированием ферментов связан механизм действия многих токсинов и ядов на организм. Известно, что при отравлениях солями сенильной кислоты смерть наступает вследствие полного торможения и выключения дыхательных ферментов (цитохромная система) тканей, особенно клеток мозга. Токсическое влияние на организм человека и животных некоторых инсектицидов обусловлено торможением активности холинэстеразы – фермента, играющего ключевую роль в деятельности нервной системы.
Современная, так называемая рациональная, химиотерапия (направленное применение лекарственных препаратов в медицине) должна основываться на точном знании механизма действия лекарственных средств на биосинтез ферментов, на активность уже синтезированных ферментов или на регуляцию их активности в организме. Иногда для лечения некоторых болезней используют избирательно действующие ингибиторы. Так, ингибитор ряда протеиназ (трипсина, химотрипсина и калликреина) трасилол широко применяется для лечения острого панкреатита – болезни, при которой уровень трипсина и химотрипсина в крови резко возрастает. Знание избирательного ингибиторного действия некоторых природных и синтетических соединений (так называемых антиметаболитов) на ферменты может служить методологической основой для разработки эффективных методов синтеза химиотерапевтических препаратов. Этот путь открывает широкие возможности для направленного воздействия на синтез ферментов в организме и регуляции интенсивности метаболизма при патологии.
Типы ингибирования. Различают обратимое и необратимое ингибиро-вание. Если ингибитор вызывает стойкие изменения пространственной третичной структуры молекулы фермента или модификацию функциональных групп фермента, то такой тип ингибирования называется необратимым. Чаще, однако, имеет место обратимое ингибирование, поддающееся количественному изучению на основе уравнения Михаэлиса-Ментен. Обратимое ингибирование в свою очередь разделяют на конкурентное и неконкурентное в зависимости от того, удается или не удается преодолеть торможение ферментативной реакции путем увеличения концентрации субстрата.
Конкурентное ингибирование может быть вызвано веществами, имеющими структуру, похожую на структуру субстрата, но несколько отличающуюся от структуры истинного субстрата. Такое ингибирование основано на связывании ингибитора с субстратсвязывающим (активным) центром. Классическим примером подобного типа ингибирования является торможение сукцинатдегидрогеназы (СДГ) малоновой кислотой. Этот фермент катализирует окисление путем дегидрирования янтарной кислоты (сукцината) в фумаровую:
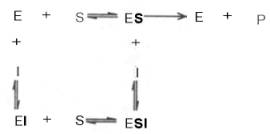
Если в среду добавить малонат (ингибитор), то в результате структурного сходства его с истинным субстратом сукцинатом (наличие двух таких же ионизированных карбоксильных групп) он будет взаимодействовать с активным центром с образованием фермент-ингибиторного комплекса, однако при этом полностью исключается перенос атома водорода от малоната. Структуры субстрата (сукцинат) и ингибитора (малонат) все же несколько различаются. Поэтому они конкурируют за связывание с активным центром, и степень торможения будет определяться соотношением концентраций малоната и сукцината, а не абсолютной концентрацией ингибитора. Таким образом, ингибитор может обратимо связываться с ферментом, образуя фермент-ингибиторный комплекс. Этот тип ингиби-рования иногда называют ингибированием по типу метаболического антагонизма (рис. 4.20).
В общей форме реакция взаимодействия ингибитора с ферментом может быть представлена следующим уравнением:
Образовавшийся комплекс, называемый фермент-ингибиторным комплексом ЕI, в отличие от фермент-субстратного комплекса ES не распадается с образованием продуктов реакции. Константу диссоциации комплекса EI, или ингибиторную константу Кi, можно, следуя теории Михаэлиса–Мен-тен, определить как отношение констант обратной и прямой реакций:
т.е. ингибиторная константа прямо пропорциональна произведению концентрации фермента и ингибитора и обратно пропорциональна концентрации комплекса EI.
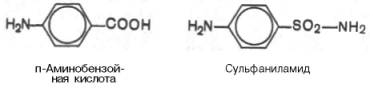
Метод конкурентного торможения нашел широкое применение в медицинской практике. Известно, например, что для лечения некоторых инфекционных заболеваний, вызываемых бактериями, применяют сульфаниламидные препараты. Оказалось, что эти препараты имеют структурное сходство с парааминобензойной кислотой, которую бактериальная клетка использует для синтеза фолиевой кислоты, являющейся составной частью
Рис. 4.20. Действие конкурентного ингибитора (схема по В.Л. Кретовичу). Е — фермент; S — субстрат; Р1 и Р2 — продукты реакции; I — ингибитор.
ферментов бактерий. Благодаря этому структурному сходству сульфаниламид блокирует действие фермента путем вытеснения парааминобензой-ной кислоты из комплекса с ферментом, синтезирующим фолиевую кислоту, что ведет к торможению роста бактерий.
Некоторые аналоги витамина В6 и фолиевой кислоты, в частности дезоксипиридоксин и аминоптерин (см. главу 7), действуют как конкурентные, так называемые коферментные, ингибиторы (или антивитамины), тормозящие многие интенсивно протекающие при патологии биологические процессы в организме. Применение подобных аналогов в медицинской практике (в частности, в дерматологии и онкологии) основано на конкурентном вытеснении коферментов из субстратсвязывающих центров ключевых ферментов обмена.
Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами и часто связывающимися не с активным центром, а в другом месте молекулы фермента. Степень торможения во многих случаях определяется продолжительностью действия ингибитора на фермент. При данном типе ингибирования благодаря образованию стабильной ковалентной связи фермент часто подвергается полной инактивации, и тогда торможение становится необратимым. Примером необратимого ингибирования является действие йодацетата, ДФФ, а также диэтил-n-нитрофенилфосфата и солей синильной кислоты. Это действие заключается в связывании и выключении функциональных групп или ионов металлов и молекуле фермента.
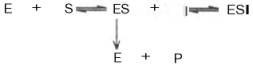
Следует указать, что неконкурентное ингибирование также может быть обратимым и необратимым, поскольку отсутствует конкуренция между субстратом и ингибитором за активный центр. Примеры необратимого ингибирования приведены ранее. При обратимом неконкурентном ингибировании субстрат S и ингибитор I связываются с разными центрами, поэтому появляется возможность образования как комплекса EI, так и тройного комплекса EIS; последний может распадаться с освобождением продукта, но с меньшей скоростью, чем комплекс ES.
Этот тип неконкурентного ингибирования чаще всего наблюдается у ферментов, катализирующих превращения более одного субстрата, когда связывание ингибитора не блокирует связывание субстрата с активным центром. Ингибитор при этом соединяется как со свободным ферментом, так и с ES-комплексом.
Известно, кроме того, так называемое бесконкурентное ингиби-рование, когда ингибитор связывается с ферментом также в некаталитическом центре, однако не со свободным ферментом, а только с ES-комплексом в виде тройного комплекса.
Для выяснения вопроса о типе ингибирования пользуются уравнениями Михаэлиса-Ментен, Лайнуивера-Бэрка или другими, например уравнением Эди-Хофсти:
и соответствующими графиками в прямолинейных координатах.
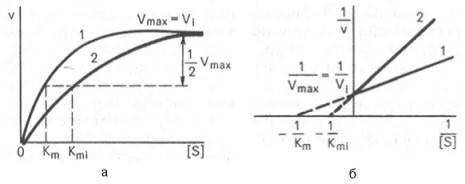
Рнс. 4.21. Графики зависимости скорости ферментативной реакции от концентрации субстрата в присутствии конкурентного ингибитора.
а — в координатах v от [ S ] ; б — в координатах 1/v от 1 / [ S ] ; Vmaxи Vi — максимальные скорости реакции; Кm и Kmi — константа Михаэлиса соответственно в отсутствие (1) и в присутствии (2) ингибитора.
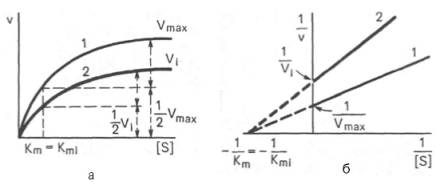
Рис. 4.22. Графики зависимости скорости ферментативной реакции от концентрации субстрата в присутствии неконкурентного ингибитора. Обозначения те же, что на рис. 4.21.
При конкурентном типе ингибирования ингибитор увеличивает значение Кm, не оказывая влияния на максимальную скорость Vmax(рис. 4.21). Это означает, что при достаточно высокой концентрации субстрата [ S ] ингибитор вытесняется молекулами субстрата из комплекса EI. При неконкурентном ингибировании (рис. 4.22) ингибитор снижает величину максимальной скорости. Если при этом величина Кm не уменьшается, то говорят о полностью неконкурентном ингибировании. Подобный тип ингибиро-вания имеет место при образовании неактивных, труднодиссоциирующих комплексов EI и(или) EIS. Часто, однако, наблюдается смешанный тип ингибирования, иногда называемый частично неконкурентным, или обратимым неконкурентным ингибированием (см. ранее), при котором снижение Vmaxсочетается с одновременным увеличением значений Кm. Это означает, что комплекс EI сохраняет частичную активность, т.е. способность к образованию промежуточного тройного комплекса EIS, в котором субстрат подвергается замедленному каталитическому превращению. В редких случаях степень торможения активности фермента может увеличиваться с повышением концентрации субстрата. Для этого типа торможения был предложен, как отмечено ранее, довольно неточный термин «бесконкурентное ингибирование». Один из механизмов такого торможения обусловлен возможностью соединения ингибитора с комплексом ES с образованием неактивного или медленно реагирующего тройного комплекса EIS.
Таким образом, при графическом анализе скоростей ферментативных реакций как функции концентраций субстрата может быть получена ценная информация не только о кинетике ферментативных реакций, но и о молекулярных механизмах ферментативного катализа.
Ситуационные задачи 1000 (стр. 23 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 |
Для выполнения расчетов:
1. Приведите схему окисления пирувата до СО2 и Н2О.
2. Укажите, как изменится энергетический выход при окислении пирувата в присутствии ротенона и 2,4- динитрофенола (полное разобщение).
Ответ:5 Пируват → 5 Ацетил-КоА → СО2 + Н2О + 75АТФ. В присутствии ротенона синтезируется 15АТФ. В присутствии 2,4- динитрофенола (полное разобщение) – 5 АТФ (только за счет субстратного фосфорилирования).
488. Сколько молекул АТФ синтезируется при окислении одной молекулы пирувата до 2-оксоглутарата; одной молекулы изоцитрата до сукцината; одной молекулы сукцината до оксалоацетатапри условии, что дегидрогеназные реакции сопряжены с дыхательной цепью?
1. Напишите ход реакций на указанных участках цикла Кребса.
2. Укажите реакции, сопряженные с дыхательной цепью.
3. Вспомните, сколько АТФ образуется при окислении НАДН и ФАДН2.
Ответ:В 1-ом случае синтезируется 6 молекул АТФ;во 2-ом — 7 молекул АТФ; в 3-ем — 5 АТФ.
489. Ротенон (токсичное вещество, вырабатываемое одним из видов растений) резко подавляет активность митохондриальной НАДН-дегидрогеназы. Токсичный антибиотик антимицин сильно ингибирует окисление убихинола. Допустим, что оба эти вещества блокируют соответствующие участки дыхательной цепи с равной эффективностью. Какой из них будет при этом более мощным ядом? Дайте аргументированный ответ.
Для обоснования ответа вспомните:
1. Что такое блокаторы дыхательной цепи?
2. На каких участках дыхательной цепи поступает водород от НАДН и ФАДН2?
Ответ:Более мощным ядом будет антимицин, так как он блокирует поступление водорода на участке от убихинола, а значит водород не поступает не только от ФАД-зависимых дегидрогеназ, но и от НАДН-дегидрогеназы.
490. К препарату изолированных митохондрий добавили амитал. Отразится ли это на потреблении кислорода?
Для обоснования ответа вспомните:
1. Как действует амитал на дыхательную цепь?
2. На каком участке дыхательной цепи он проявляет своё действие?
Ответ:Потребление кислорода снизится, так как блокируется убихинолдегидрогеназа.
491. 2,4-ДНФ (сильный разобщающий агент) пытались одно время использовать для борьбы с ожирением. Теперь такого рода разобщающие агенты уже не применяются в качестве лекарственных препаратов, поскольку известны случаи, когда их применение приводило к летальному исходу. На чем могло быть основано такое использование2,4-ДНФ? Почему прием разобщающих агентов может вызвать смерть?
Для обоснования ответа вспомните:
1. Что такое разобщители?
2. На чём основано действие 2,4-ДНФ?
3. Изменится ли скорость окисления в дыхательной цепи в присутствии 2,4-ДНФ?
Ответ:Разобщители повышают потребление кислорода и скорость переноса электронов по дыхательной цепи, но разобщают окисление и фосфорилирование. В результате образование АТФ резко снижается, что может вызвать смерть.
492. Некоторые бактерии, дрожжи, паразитирующие черви не нуждаются в кислороде. Какой из двух способов образования АТФ используется у этих организмов для аккумуляции энергии?
Для ответа вспомните:
1. Что такое фосфорилирование?
2. Что такое субстратное и окислительное фосфорилирование?
3. Чем эти виды фосфорилирования отличаются друг от друга?
Ответ:Для аккумуляции энергии у данных организмов используется субстратное фосфорилирование.
493. Добавление к митохондриям олигомицина вызывает снижение как переноса электронов от НАДН к О2, так и скорости образования АТФ. Последующее добавление 2,4-ДНФ приводит к увеличению скорости переноса электронов без сопутствующего изменения скорости синтеза АТФ. Какую реакцию ингибирует олигомицин?
Для ответа вспомните:
1. Чем является 2,4-ДНФ для дыхательной цепи?
2. Чем действие блокаторов отличается от действия разобщителей?
Ответ:Олигомицин блокирует протонную АТФ-синтетазу, поэтому синтеза АТФ не происходит.
494. Немедленное введение метиленовой сини оказывает очень эффективное лечебное действие при отравлении цианидами. Какова основа её противотоксического действия, если учесть, что метиленовая синь способна окислять часть гемоглобина (Fe2+) крови в метгемоглобин (Fe3+)?
Для ответа вспомните:
1. В чём сходство простетических групп цитохромов и гемоглобина?
2. С железом какой валентности связываются цианиды?
Ответ:После того, как метиленовая синь переводит часть гемоглобина в метгемоглобин, цианиды получают возможность связываться не с цитохромом а3 клеток, а с метгемоглобином в эритроцитах, который содержит необходимое для связывания трехвалентное железо.
495. В инкубационную среду с изолированными митохондриями добавили АДФ. Как это повлияет на способность митохондрий поглощать кислород?
Для обоснования ответа:
1. Напишите схему цикла Кребса и дыхательной цепи.
2. Вспомните, что такое дыхательный контроль?
Ответ:Скорость поглощения кислорода митохондриями увеличится, так как АДФ является активатором работы дыхательной цепи.
496. В инкубационную смесь внесены митохондрии, избыток субстрата и ограниченное количество АДФ. Как будет изменяться со временем скорость поглощения кислорода и почему?
Для обоснования ответа:
1. Напишите схему цикла Кребса и дыхательной цепи.
2. Вспомните, что такое дыхательный контроль?
Ответ:Сначала скорость поглощения кислорода увеличится, а со временем снизится, так как АДФ в ходе реакции превращается в АТФ.
497. При добавлении к суспензии митохондрий изоцитрата скорость поглощения кислорода увеличивается. При добавлении малоната — снижается. Почему прекращается потребление кислорода?
1. Напишите реакцию, которая активируется изоцитратом.
1. Укажите, какой промежуточный метаболит цикла Кребса накапливается при добавлении малоната и почему?
2. Каким образом можно восстановить скорость дыхания?
Ответ:Малонат является конкурентным ингибитором сукцинатдегидрогеназы, поэтому работа цикла Кребса затормозится. Восстановленные коферменты не поступают в дыхательную цепь, и потребление кислорода снижается.
498. В эксперименте к изолированным митохондриям добавили малат. Чему равен коэффициент Р/О для малата?
Для обоснования ответа:
1. Вспомните, что такое коэффициент Р/О?
2. Напишите реакцию окисления малата и укажите фермент.
Ответ:Коэффициент фосфорилирования ( Р/О) для малата равен 3, так как малатдегидрогеназа является НАД-зависимым ферментом.
499. В эксперименте к изолированным митохондриям добавили сукцинат. Чему равен коэффициент Р/О для сукцината?
Для обоснования ответа:
1. Вспомните, что такое коэффициент Р/О?
2. Напишите реакцию окисления сукцината и укажите фермент.
Ответ:Коэффициент фосфорилирования ( Р/О) для сукцината равен 2, так как сукцинатдегидрогеназа является ФАД-зависимым ферментом.
500. К суспензии митохондрий с цитратом добавили амитал. Как изменится коэффициент Р/О?
Для обоснования ответа:
1. Вспомните, что такое коэффициент Р/О?
2. Чему равен Р/О для изоцитрата?
3. Как влияет амитал на работу дыхательной цепи?
Ответ:Коэффициент фосфорилирования ( Р/О) будет меньше 3, так как амитал является блокатором дыхательной цепи. Перенос электронов с изоцитрата будет заблокирован.
501. Митохондрии бурого жира постоянно находятся в разобщенном состоянии. В чем биологический смысл данного феномена?
1.Чем обусловлен бурый цвет ткани?
2. Почему эта ткань в заметных количествах присутствует у новорожденных, а у взрослых сохраняется в следовых количествах?
Ответ:Бурый жир выполняет термогенную функцию, что особенно важно для новорожденных, так как у них не сформирована система терморегуляции. Бурый цвет ткани обусловлен большим количеством цитохромов.
502. Животному внутривенно ввели стерильный раствор сахарозы. Появится ли сахароза в моче?
Для ответа вспомните:
1. Что такое сахароза?
2. Каким превращениям в организме она подвергается?
Ответ:Появится, так как в тканях нет фермента, расщепляющего сахарозу, и она будет выведена из организма с мочой.
503. Употребление в пищу кондитерских изделий, конфет вызывает у ребенка рвоту, понос. Он плохо переносит и сладкий чай, тогда как молоко не вызывает отрицательных реакций. Выскажите предположение о молекулярном дефекте.
Для обоснования ответа вспомните:
1. Какой дисахарид содержится в кондитерских изделиях, а какой — в молоке?
2. Что такое энзимопатия?
3. Какие виды энзимопатий вы знаете?
Ответ:Можно предположить дисахаридоз, вызванный отсутствием сахаразы. Возможной причиной перечисленных симптомов также может быть наследственная непереносимость фруктозы (дефект альдолазы фруктозо-1-фосфата).
504. У некоторых людей прием молока вызывает расстройство кишечника, а прием простокваши — нет. Почему это происходит?
Для обоснования ответа вспомните:
1. Чем отличаются по составу молоко и простокваша?
2. Какой углевод содержится в молоке?
3. Что может быть причиной кишечных расстройств в данном случае?
Ответ:У людей с недостаточностью лактазы в кишечном соке лактоза молока становится питательной средой для кишечных бактерий. В простокваше лактоза отсутствует, так как она расщепляется микроорганизмами.
505. Больной страдает от судорог в мышцах при напряженной физической работе, но в остальном чувствует себя здоровым. Биопсия мышечной ткани выявила, что концентрация гликогена в мышцах этого больного гораздо выше нормы. Почему накапливается гликоген? Ваши рекомендации такому человеку.
1. Напишите схему обмена гликогена.
2. Укажите, какой из процессов обмена гликогена нарушен у данного больного?
3. Что такое энзимопатии?
Ответ:У больного мышечная форма гликогеноза (возможна болезнь Мак-Ардла). Рекомендации: режим работы и отдыха, избегать напряженной физической работы; прием пищи частый, небольшими порциями.
506. Клинические симптомы двух форм галактоземии, одна из которых обусловленанедостаточностью галактокиназы, а другая — галактозо-1-фосфат-уридилтрансферазы, резко различаются по своей тяжести. И в том, и в другом случае молоко вызывает у больных кишечные расстройства, но при недостаточности галактозо-1-фосфат-уридилтрансферазы нарушаются функции печени, почек, селезенки и мозга, а затем наступает смерть. Какие продукты накапливаются в крови и тканях при недостаточности каждого из двух ферментов? Оцените сравнительную токсичность этих продуктов на основе приведенных выше данных.
http://xumuk.ru/biologhim/053.html
http://pandia.ru/text/80/237/17733-23.php