Презентация на тему: АКТИВНОСТИ АМИНОТРАНСФЕРАЗ АСТ И АЛТ
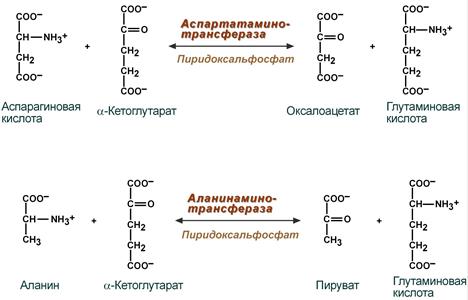
Трансферазы- ферменты, катализирующие перенос различных групп атомов от одной молекулы к другой. Трансферазы- ферменты, катализирующие перенос различных групп атомов от одной молекулы к другой. АМИНОТРАСФЕРАЗЫ- катализируют перенос аминогруппы от аминокислоты на кетокислоту. АЛАНИНАМИНОТРАНСФЕРАЗА- катализирует перенос аминогруппы от Ĺаланина к α –кетоглутаровой ислоте. АСПАРТАТАМИНОТРАСФЕРАЗА- катализирует перенос аминогруппы от аспарагиновой кислоты к α –кетоглутаровой ислоте
Аминотрансферазы: аланинаминотранс Аминотрансферазы: аланинаминотранс фераза (АЛТ), аспартатаминотрансфераза (АСТ)-близкие по действию ферменты, участвующие в обмене аминокислот. Коферметом является пиридоксальфосфат. Реакция обратима.
Клиническое значение аминотрансфераз Клиническое значение аминотрансфераз Аминотрансферазы — ферменты, катализирующие межмолекулярный перенос аминогруппы между аминокислотами и кетокислотами. Наибольшее клинико-диагностическое значение имеет определение двух аминотрансфераз: аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ). Различия в наименовании аминотрансфераз определяются названием той аминокислоты, от которой отделяются аминогруппа. Фермент, катализирующий перенос аминогруппы с аспарагиновой кислоты на кетоглутаровую кислоту, получил название АСТ. Фермент же, катализирующий обратимый перенос аминогруппы с аланина на кетоглутаровую кислоту называется АЛТ.
Фермент АСТ имеется во всех тканях тела, но наибольшая активность его наблюдается в печени, сердце, скелетных мышцах и эритроцитах. Наименьшая активность АСТ отмечена в коже, почках, поджелудочной железе. Фермент АСТ имеется во всех тканях тела, но наибольшая активность его наблюдается в печени, сердце, скелетных мышцах и эритроцитах. Наименьшая активность АСТ отмечена в коже, почках, поджелудочной железе.
Самое большое количество АЛТ находится в печени, что определяет важное диагностическое значение активности фермента при заболеваниях этого органа Самое большое количество АЛТ находится в печени, что определяет важное диагностическое значение активности фермента при заболеваниях этого органа
Нормальная активность АСТ в сыворотке крови— 10-20 МЕ/л или до 40 ед. Нормальная активность АСТ в сыворотке крови— 10-20 МЕ/л или до 40 ед. Нормальная активность АЛТ в сыворотке крови — 7-40 МЕ/л или до 40 ед.
При поражении клеток печени вирусами, различными химическими веществами, в том числе алкоголем и лекарствами (гепатиты), а также при нарушении оттока желчи из-за сдавления желчного протока или его закупорки камнями, активность АЛТ в крови существенно увеличивается пропорционально тяжести заболевания, и в острых случаях может в 5-10 раз превышать норму. Повышение активности фермента происходит значительно раньше, чем другие очевидные признаки заболевания (желтуха, болевые ощущения и др.). При поражении клеток печени вирусами, различными химическими веществами, в том числе алкоголем и лекарствами (гепатиты), а также при нарушении оттока желчи из-за сдавления желчного протока или его закупорки камнями, активность АЛТ в крови существенно увеличивается пропорционально тяжести заболевания, и в острых случаях может в 5-10 раз превышать норму. Повышение активности фермента происходит значительно раньше, чем другие очевидные признаки заболевания (желтуха, болевые ощущения и др.). Определение активности АЛТ обязательно для всех доноров крови для исключения хронических заболеваний печени.
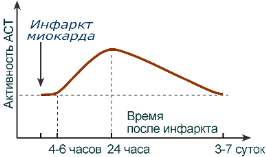
АСТ в большом количестве находится в сердце и печени, что используется для диагностики заболеваний этих органов. АСТ в большом количестве находится в сердце и печени, что используется для диагностики заболеваний этих органов. Повышение активности фермента происходит при тех же заболеваниях печени, что и АЛТ, но пропорция между увеличением АСТ и АЛТ при разных заболеваниях различна, поэтому их одновременное определение дает врачу хорошую информацию для постановки точного диагноза. Увеличение активности фермента при инфаркте миокарда происходит через 6-8часов, максимальная активность через 24-36 часов и снижается до нормы через5-6 дней.
Для постановки диагноза важно значение коэффициента Для постановки диагноза важно значение коэффициента Де Ритиса (АСТ/АЛТ)=1,33. При заболевании печени величина ниже этого значения, при заболеваниях сердца –выше. Снижение активности АСТ и АЛТ ниже нормы встречается только при тяжелых поражениях печени, когда значительно уменьшается количество клеток, синтезирующих эти ферменты (обширный некроз, цирроз). Период полувыведения АСТ составляет 17 часов, АЛТ-47часов. АЛТ локализуется преимущественно в цитоплазме гепатоцитов. АСТ в цитоплазме и митохондриях клетки.
АСТ и АЛТ обладают различной активностью в различных органах и тканях. Наибольшая активность АСТ наблюдается в сердечной мышце, а АЛТ в ткани печени.В сыворотке активность аминотрасфераз низка и заметно повышается при нарушении целостности мембран клеток печени или сердечной мышцы. АСТ и АЛТ обладают различной активностью в различных органах и тканях. Наибольшая активность АСТ наблюдается в сердечной мышце, а АЛТ в ткани печени.В сыворотке активность аминотрасфераз низка и заметно повышается при нарушении целостности мембран клеток печени или сердечной мышцы.
Определение активности в сыворотке крови является важным тестом для диагностики инфаркта миокарда и вирусного гепатита. Изучают активность АЛТ и АСТ в сыворотке крови, а также В тканях печени и сердца. Определение активности в сыворотке крови является важным тестом для диагностики инфаркта миокарда и вирусного гепатита. Изучают активность АЛТ и АСТ в сыворотке крови, а также В тканях печени и сердца.
СХЕМА ПРИНЦИПА МЕТОДА: СХЕМА ПРИНЦИПА МЕТОДА: АЛТ Α-аланин + ά-кетоглутаровая кислота → ПВК+2,4ДНФГ→ гидразон ПВК + NaOH → коричневое окрашивание. АСТ Аспарагиновая аминокислота + ά-кетоглутаровая кислота → ПВК+2,4ДНФГ→ гидразон ПВК + NaOH → коричневое окрашивание АЛТ и АСТ –ферменты ; аланин, аспарагиновая кислота, кетоглутаровая кислота-субстрат ; 2,4ДНФГ-ингибитор ; гидразон ПВК -продукт реакции. При определении активности АСТ и АЛТ пользуются тем, что образующийся продукт реакции пировиноградная кислота (ПВК) при добавлении 2,4 динитрофенилгидрозина (2,4ДНФГ) образует окрашенный гидразон ПВК в щелочной среде. Интенсивность окраски прямо пропорционально количеству образовавшейся ПВК, а значит и активности фермента.
1этап-подготовительный 1этап-подготовительный 2этап-ферментативная реакция 3этап-остановка ферментативной реакции 4этап-обнаружение продукта реакции 5этап-измерение оптической плотности раствора 6этап-расчет по калибровочной кривой 7этап-интерпретация результатов
Приготовление 0,4 н NaOH. Приготовление 0,4 н NaOH. Содержимое флакона NaOH (4,0моль/л) развести в 10 раз.
ВОПРОСЫ. ВОПРОСЫ. 1.К какому классу ферментов относятся аминотрансферазы. 2.Какую реакцию катализируют АСТ и АЛТ. 3.Какую роль выполняют в организме человека аминотрансферазы. 4.Какие патологические состояния можно диагностировать при повышении активности АЛТ, АСТ. 5.Составте схему анализа. 6.Какую роль при проведении анализа выполняют физ р-р; 2,4ДНФГ; 0,4 н NaOH. 7.Перечислите этапы анализа, их суть. 8.Укажите нормальные показатели активности АЛТ и АСТ. 9.Укажите название метода определения активности аминотрасфераз. 10.В чем состоит принцип метода. 11.Как определить активность фермента. 12.Как построить калибровочную кривую. 13.КДЗ исследований.
ЗАДАЧИ. ЗАДАЧИ. 1.При проведении анализа активность АЛТ и АСТ увеличилась более чем 10 раз. Какое патологическое состояние можно предположить. 2. При проведении анализа активность АСТ увеличилась более чем 5 раз, а активность АЛТ изменилась незначительно. Какое патологическое состояние можно предположить. 3.При определении коэффициента Де Ритиса, значение больше, чем 1,33. Что это означает. 4. .При определении коэффициента Де Ритиса, значение меньше, чем 1,33. Что это означает. 5.Больной обратился в ЛПУ с жалобами на сильные боли в области сердца с иррадиацией в левую лопатку, руку, шею. Какой анализ необходимо провести. 6. .Больной обратился в ЛПУ с жалобами на общую слабость, недомогание, похудание, потерю аппетита, тошнота, боль в правом подреберье. Какой анализ необходимо провести. 7.При проведении анализа кровь больного попала на халат. Ваши действия. 8.При проведении анализа кровь больного попала на стол. Ваши действия.
К какому классу ферментов относятся АЛТ и АСТ? К какому классу ферментов относятся АЛТ и АСТ? Изомеразы Трансферазы Гидролазы Лиазы Концентрация какого вещества изменяется в процессе исследования активности АСТ и АЛТ? Фермента Продукта реакции Субстрата реакции Ингибитора реакции Какова роль 2,4 – ДНФГ при определении активности аминотрансфераз? Это цветной реактив Активатор реакции Ингибитор фермента Субстрат Какой фермент катализирует следующие превращения — &-аланин + &- кетоглутаровая кислота->ПВК? ЛДГ &-амилаза АЛТ АСТ Какие из перечисленных ферментов относятся к классу гидролаз? ЛДГ АЛТ &-амилаза АСТ
Аминотрансферазы имеют клиническое значение
В лабораторной диагностике нашло практическое применение определение активности двух ферментов трансаминирования – аланинаминотрансферазы (АЛТ, АлАТ) и аспартатаминотрансферазы (АСТ, АсАТ).
Оба фермента обратимо взаимодействуют с α-кетоглутаровой кислотой и переносят на нее аминогруппы от соответствующих аминокислот с образованием глутаминовой кислоты и кетокислот.
Реакции, катализируемые аланинаминотрансферазой
и аспартатаминотрансферазой
В настоящее время аминотрансферазы теряют свое диагностическое значение в связи с низкой клинической специфичностью. Представленное ниже описание имеет в основном историческое значение.
Хотя активность обоих ферментов значительно возрастает при заболеваниях сердечной мышцы и печени, при поражении клеток миокарда наибольшая активность в сыворотке крови обнаруживается для АСТ, при нарушении печени (гепатиты различного генеза) – для АЛТ.
Изменение активности АСТ в сыворотке крови после инфаркта миокарда
В клинической практике определение активности АЛТ и АСТ используется для дифференциальной диагностики болезней печени и миокарда, глубины поражения и контроля эффективности их лечения.
Инструкция по применению набора реагентов для определения активности аспартатаминотрансферазы в сыворотке и плазме крови человека кинетическим методом
по применению набора реагентов для определения активности аспартатаминотрансферазы в сыворотке и плазме крови человека кинетическим методом
Набор АСТ-UTS разрешен к производству, продаже и применению на территории РФ.
Регистрационное удостоверение № ФСР 2009/05460
Информация для заказа набора «АСТ-UTS»
Р1 80 мл + Р2 20 мл
Р1 320 мл + Р2 80 мл
*где v – объем фотометрической ячейки анализатора.
1. НАЗНАЧЕНИЕ
1.1. Набор реагентов «АСТ-UTS» предназначен для определения активности аспартатаминотрансферазы в сыворотке или плазме крови человека в клинико-диагностических и биохимических лабораториях для целей диагностики заболеваний и контроля проводимого лечения пациентов.
1.2. АСТ – это внутриклеточный фермент, который присутствует в цитоплазме и митохондриях клеток печени, скелетных мышц, миокарда, почек, мозга, а также в эритроцитах [1,2]. АСТ относится к классу аминотрансаминаз, которые катализируют обратимую реакцию переноса аминогруппы с аспарагиновой кислоты (аминокислота) на α-кетоглютаровую кислоту (α-кетокислота):
R1-аминокислота + R2-α-кетокислота R1-α-кетокислота + R2-аминокислота
АСТ попадает в кровь вследствие цитолиза клеток, содержащих этот фермент. На этом основано клиническое значение анализа.
1.3. Потенциальный риск применения набора – класс 2а. Основной риск косвенный и связан с возможностью получения неверного результата анализа, что может привести к неправильно поставленному диагнозу и назначению неэффективного лечения пациента. Для снижения указанного риска необходимо в каждой аналитической серии контролировать качество результатов анализов с применением контрольных сывороток в соответствии с ОСТ 91500.13..
2. ПРИНЦИП МЕТОДА
2.1. Набор реагентов «АСТ-UTS» разработан на основе стандартного кинетического УФ-метода (IFCC) без пиридоксаль-5-фосфата. АСТ катализирует реакцию переноса аминогруппы с L-аспартата на a-кетоглютарат, образуя оксалоацетат и L-глютамат (1). Затем в присутствии малатдегидрогеназы (МДГ) происходит восстановление оксалоацетата до малата за счет окисления НАДН2 (2).
L-Аспартат + α-кетоглютарат АСТ Оксалоацетат + Глютамат (1)

Скорость окисления НАДН2 прямо пропорциональна активности АСТ и измеряется фотометрически при 340 нм [3].
2.2. Фотометрическое измерение основано на наличии максимума поглощения света на длине волны 340 нм молекулами НАДН2. Все остальные компоненты реакционной смеси не поглощают свет на этой длине волны. Таким образом, уменьшение оптической плотности реакционной смеси на длине волны 340 нм пропорционально уменьшению концентрации НАДН2. При достаточно высокой концентрации субстратов АСТ, НАДН2 и высокой активности МДГ скорость уменьшения концентрации НАДН2 и, следовательно, уменьшение оптической плотности реакционной смеси будет пропорциональна активности АСТ.
3. СОСТАВ НАБОРА
3.1. Поскольку рабочий реагент, содержащий все компоненты для обеспечения химических реакций (1) и (2), не стабилен, набор реагентов поставляется в виде двух растворов Р1 и Р2.
http://biokhimija.ru/obmen-aminokislot/transaminazy.html
http://pandia.ru/text/78/237/77629.php