Уравнение реакции между хлором и сурьмой окислитель
Курс общей и неорганической химии
(для студентов биологического факультета (биофизиков)
и для студентов факультета биоинженерии и биоинформатики)
Программа курса. Материалы лекций. Презентации лекций. Программа сетевых контрольных мероприятий
Лектор — Загорский Вячеслав Викторович — ст.н.сотр., к.х.н., д.п.н.
Реакция сурьмы с хлором
Посмотреть видео:
Порошок сурьмы реагирует с хлором мгновенно при комнатной температуре. Реакция идет с образованием яркого пламени и дыма.
В стакан, заполненный хлором, постепенно всыпают немного порошка сурьмы. Образуется «огненный дождь».
Автор и оператор
Загорский В.В.
Ассистент
Петрова Е.П.
Подготовка публикации
Мочалыгин А.Г.
Редактирование
Миняйлов В.В.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Напишите уравнения реакций: а) между хлором и сурьмой; б) между хлором и водородом. Укажите условия протекания этих реакций, а также окислитель и восстановитель
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,300
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,282
- разное 16,837
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Хлорид сурьмы III
| Хлорид сурьмы III | |
|---|---|
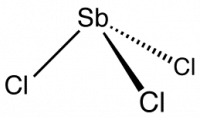 | |
| Систематическое наименование | Трихлорид сурьмы |
| Традиционные названия | хлористая сурьма |
| Хим. формула | SbCl3 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 228,11 г/моль |
| Плотность | 3,14 г/см³ |
| Температура | |
| • плавления | 72,3; 73,4 °C |
| • кипения | 218,6; 221; 222,6; 223 °C |
| Мол. теплоёмк. | 108 Дж/(моль·К) |
| Энтальпия | |
| • образования | -282,2 кДж/моль |
| Растворимость | |
| • в воде | 920 25 ; 1917 50 ; ∞ 100 г/100 мл |
| Рег. номер CAS | 10025-91-9 |
| PubChem | 24814 |
| Рег. номер EINECS | 233-047-2 |
| SMILES | |
| RTECS | CC4900000 |
| ChEBI | 74856 |
| Номер ООН | 1733 |
| ChemSpider | 23199 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорид сурьмы III — бинарное неорганическое соединение сурьмы и хлора с формулой SbCl3, бесцветные кристаллы, очень хорошо растворимые в холодной воде.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
Получение
- Действие хлора на металлическую сурьму:
2 Sb + 3 Cl2 → 2 SbCl3
- Действием хлористого водорода на триоксид сурьмы:
Sb2O3 + 6 HCl → 60−80oC 2 SbCl3 + 3 H2O
- Действием хлора на триоксид сурьмы:
2 Sb2O3 + 6 Cl2 → 1000oC 4 SbCl3 + 3 O2
- Действием хлора на сульфид сурьмы:
2 Sb2S3 + 9 Cl2 → 250oC 4 S SbCl3 + 3 S2Cl2
Физические свойства
Хлорид сурьмы III образует бесцветные гигроскопичные диамагнитные кристаллы. Вызывает ожоги на коже. Очень хорошо растворимые в воде. Концентрированные водные растворы устойчивы и называются «сурьмяное масло» (едкая, жгучая, ядовитая жидкость). Разбавленные водные растворы подвергаются гидролизу.
Растворяется в хлороформе, четырёххлористом углероде, бензоле, диоксане и других органических растворителях.
http://www.soloby.ru/295417/%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4%D0%BE%D0%BC-%D0%BF%D1%80%D0%BE%D1%82%D0%B5%D0%BA%D0%B0%D0%BD%D0%B8%D1%8F-%D0%BE%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C-%D0%B2%D0%BE%D1%81%D1%81%D1%82%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%82%D0%B5%D0%BB%D1%8C
http://chem.ru/hlorid-surmy-iii.html


