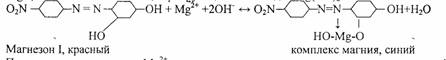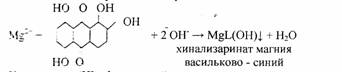Магний: способы получения и химические свойства
Магний Mg — это щелочной металл. Серебристо-белый, относительно мягкий, пластичный, ковкий металл. На воздухе покрыт оксидной пленкой. Сильный восстановитель.
Относительная молекулярная масса Mr = 24,305; относительная плотность для твердого и жидкого состояния d = 1,737; tпл = 648º C; tкип = 1095º C.
Способ получения
1. В результате электролиза расплава хлорида магния образуются магний и хлор :
2. Нитрид магния разлагается при 700 — 1500º С образуя магний и азот:
3. Оксид магния легко восстанавливается углеродом при температуре выше 2000º С, образуя магний и угарный газ:
MgO + C = Mg + CO
4. Оксид магния также легко восстанавливается кальцием при 1300º С с образованием магния и оксида кальция:
MgO + Ca = CaO + Mg
Качественная реакция
Качественной реакцией для магния является взаимодействие соли магния с любой сильной щелочью, в результате которой происходит выпадение студенистого осадка:
1. Хлорид магния взаимодействует с гидроксидом калия и образует гидроксид магния и хлорид калия:
MgCl2 + 2KOH = Mg(OH)2 + 2KCI
Химические свойства
1. Магний — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Магний взаимодействует с азотом при 780 — 800º С образуя нитрид магния:
1.2. Магний сгорает в кислороде (воздухе) при 600 — 650º С с образованием оксида магния:
2Mg + O2 = 2MgO
1.3. Магний активно реагирует при комнатной температуре с влажным хлором . При этом образуется хлорид магния :
1.4. С водородом магний реагирует при температуре 175º C, избыточном давлении и в присутствии катализатора MgI2 с образованием гидрида магния:
2. Магний активно взаимодействует со сложными веществами:
2.1. Магний реагирует с горячей водой . Взаимодействие магния с водой приводит к образованию гидроксида магния и газа водорода:
2.2. Магний взаимодействует с кислотами:
2.2.1. Магний реагирует с разбавленной соляной кислотой, при этом образуются хлорид магния и водород :
Mg + 2HCl = MgCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой магний образует нитрат магния, оксид азота (I) и воду:
2.2.3. В результате реакции сероводородной кислоты и магния при 500º С образуется сульфид магния и водород:
Mg + H2S = MgS + H2
2.3. Магний вступает в реакцию с газом аммиаком при 600 — 850º С. В результате данной реакции образуется нитрид магния и водород:
2.4. Магний может вступать в реакцию с оксидами :
2.4.1. В результате взаимодействия магния и оксида азота (IV) при температуре 150º С в вакууме, в этилацетилене образуется нитрат магния и оксид азота (II):
2.4.2. Магний взаимодействует с оксидом кремния при температуре ниже 800º С в атмосфере водорода образуя силицид магния и оксид магния:
4Mg + SiO2 = Mg2Si + MgO,
а если температуру поднять до 1000º С, то в результате реакции образуется кремний и оксид магния:
2Mg + SiO2 = Si + 2MgO
Химико-аналитические свойства ионов s-элементов
Химико-аналитические свойства ионов s-элементов
Ионы s-элементов IA группы
Катионы натрия и калия относятся к I аналитической группе, которая характеризуется отсутствием группового реагента, т. е. реактива, способного осаждать все катионы этой группы из их растворов.
Следует иметь в виду, что приведенные ниже реагенты, используемые для исследования растворов на содержание в них ионов калия и натрия, дают аналогичный эффект с катионом аммония. Поэтому использование этих реагентов возможно после предварительного испытания раствора на содержание в нем катиона аммония.
Реакция обнаружения катиона калия K +
Гексанитрокобальтат (III) натрия Nа 3 [Со(NO 2 ) 6 ] образует с ионами калия желтый кристаллический осадок гексанитрокобальтата (III) калия-натрия:
2 КС l + Na 3 [Co(NO 2 ) 6 ] = K 2 Na[Co(NO 2 ) 6 ] Ї + 2NaCl,
2 К + + Na + + [Co(NO 2 ) 6 ] 3- = K 2 Na[Co(NO 2 ) 6 ] Ї .
Обнаружение иона К + с помощью гексанитрокобальтата (III) натрия проводят в нейтральном и слабокислом растворах, так как в щелочной среде и в присутствии сильных кислот реагент разлагается.
Реакция обнаружения катиона натрия Na +
Гексагидроксостибиат (V) калия К[Sb(ОН) 6 ] образует с ионом натрия белый кристаллический осадок гексагидроксостибиата (V) натрия:
NaCI + К[Sb(ОН) 6 ] = Na[Sb(OH) 6 ] Ї + КСl,
Na + + [Sb(OH) 6 ] = Na[Sb(OH) 6 ] Ї .
Обнаружение иона Na + с помощью гексагидроксостибиата (V) калия проводят в нейтральном или слабощелочном растворе, так как кислоты разлагают реагент, а щелочи растворяют осадок Na[Sb(OH) 6 ] с образованием хорошо растворимой средней соли.
Ионы s-элemeнтов IIA группы
Катионы магния, кальция, (бария и стронция относятся ко II аналитической группе, которая характеризуется наличием группового реагента (NН 4 ) 2 СОз, осаждающего любой из приведенных катионов из его раствора.
Реакции обнаружения катиона магния Mg 2+
Действие группового реагента. Карбонат аммония (NH 4 ) 2 СОз с раствором соли магния образует белый аморфный осадок основной соли (MgOH) 2 CO 3 , растворимый в избытке NH 4 Cl:
2MgCl 2 + 2(NH 4 ) 2 CO 3 + Н 2 О = (MgOH) 2 CO 3 Ї + СО 2 + 4NH 4 Cl,
2Mg 2+ + 2CO 3 2- + Н 2 О = (MgOH) 2 CO 3 Ї + CO 2 .
Реакция обнаружения. Едкие щелочи и гидроксид аммония образуют с растворами солей магния белый аморфный осадок Mg(OH) 2 , хорошо растворимый в кислотах и растворах аммонийных солей:
Mg 2+ + 2O Н — = Mg(OH) 2 Ї
Растворение в кислотах:
Mg(OH) 2 + 2H + = Mg 2+ + 2Н 2 O.
Растворение в растворах аммонийных солей:
Mg(OH) 2 + 2NH 4 + = Mg 2+ + 2NH 4 OH.
Реакции обнаружения катиона бария Ва 2+
Действие группового реагента. Карбонат аммония (NН 4 ) 2 СО 3 осаждает катион Ва 2+ из растворов его солей в виде белого аморфного постепенно кристаллизующегося осадка ВаСО 3 :
BaCl 2 + (NH 4 ) 2 CO 3 = ВаСО 3 Ї + 2NH 4 Cl,
Ва 2+ + CO 3 2- = ВаСО 3 Ї.
Осадок хорошо растворим в кислотах, в том числе и слабых.
Реакция обнаружения. Дихромат калия К 2 Сг 2 O 7 образует с раствором соли бария желтый осадок ВаСгO4, нерастворимый в уксусной кислоте, в отличие от хромата стронция (хромат кальция хорошо растворяется в воде):
2Ba 2+ + Сг 2 O 7 2- + Н 2 O = 2ВаСгO 4 Ї + 2H + .
Реакцию проводят при избытке CH 3 COONa, который реагирует с образующимися ионами Н + , смещая равновесие вправо вследствие образования малодиссоциированной уксусной кислоты:
СН 3 СОС — + Н + = СН 3 СООН.
Реакции обнаружения катиона кальция Са 2+
Действие группового реагента. Карбонат аммония (NН 4 ) 2 СО 3 осаждает из растворов солей кальция аморфный белый осадок СаСО 3 , который при нагревании переходит в кристаллический:
CaCl 2 + (NH 4 ) 2 CO 3 = СаСО 3 Ї + 2NH 4 C1,
Ca 2+ CO 3 2- = СаСО 3 Ї .
Осадок легко растворяется в минеральных и уксусной кислотах.
Реакция обнаружения. Оксалат аммония (NH 4 ) 2 C 2 O 4 образует с раствором соли кальция белый кристаллический осадок, растворимый в соляной, но не растворимый в уксусной кислоте:
CaCl 2 + (NH 4 ) 2 C 2 O 4 = СаС 2 O 4 Ї + 2NH 4 C1,
Ca2+ + С 2 O 4 2- = СаС 2 O 4 .
Аналогичный осадок дают ионы Ва 2+ и Sr 2+ . Поэтому этой реакцией можно обнаружить Са 2+ только при отсутствии ионов бария и стронция.
Реакции обнаружения катиона стронция Sr 2+
Действие группового реагента. Карбонат аммония (NH 4 ) 2 CO3 При взаимодействии с растворами солей стронция осаждает карбонат стронция белого цвета, растворимый в уксусной, соляной и азотной кислотах:
SrCl 2 + (NH 4 ) 2 CO 3 = SrCO 3 Ї + 2NH 4 C1.
Реакция обнаружения. Насыщенный раствор гипса CaSO 4 . 2H 2 O (гипсовая вода) образует с ионами Sr 2+ белый осадок сульфата стронция:
Sr 2+ + SO 4 2- = SrSO 4 Ї .
Однако при действии гипсовой воды ион стронция дает не обильный осадок, а только помутнение, появляющееся не сразу из-за образования пересыщенного раствора. Появление осадка ускоряют нагреванием.
Реакция служит для обнаружения Sr 2+ только при отсутствии Ba 2+ , которой с гипсовой водой вызывает помутнение, появляющееся сразу, так как растворимость BaSO 4 меньше растворимости SrSO 4 (K s 0 (BaSO 4 ) = 1,1 . 10 -10 , K s 0 (SrSO 4 ) = 2,8 . 10 -7 ).
Гипсовая вода не образует осадков с растворами солей кальция ни на холоду, ни при нагревании. Этим ион Ca 2+ отличается от ионов Ba 2+ и Sr 2+ .
Chemicals-el.ru
» Сайт о химических элементах
Аналитические реакции катионов магния Mg 2+
1. Реакция с щелочами и аммиаком: Mg2+ + 2 ОН- —> Mg(OH)2 (белый аморфный)
Mg2+ + 2 NHrH2O = Mg(OH)2 + 2 NH4+
Осадок не растворяется в щелочах, растворяется в НС1, H2SO4, CH3COOH: Mg(OH)2 + 2 Н+ -► Mg2+ + 2 Н2О
2. Реакция с гидрофосфатом натрия Na2HPO4 (фармакопейная).
Реакцию проводят в аммиачном буфере:
Mg2+ + НРО42- + NH3 — NH4MgPO4 | (белый кристаллический) При проведении реакции в отсутствии катионов аммония и аммиака выпадает белый аморфный осадок MgHPO4. Избыток NH4 мешает выпадению NH4MgPO4. Осадок NH4MgPO4 растворяется в минеральных кислотах и в уксусной кислоте:
NH4MgPO4 + 3 НС1 — Н3РО4 + MgCl2 + NH4C1
NH4MgPO4+ 2 CHjCOOH = NH4H2PO4 + (CH3COO)2Mg
Проведению реакции мешают катионы Li+, Ca2+, Sr2, Ba2+ и др.
3. Реакция с магнезоном I — п — нитробензолазорезорцином.
В щелочной среде магнезон I, имеющий красную окраску, образует с катионами М^2+,комплекс синего цвета, сорбирующийся на осадке Mg(OH)2:
При малых концентрациях Mg2+ осадок не выделяется, а раствор окрашивается в синий цвет. Проведению реакции мешают Cd2+, Sn2+, Cr3+, Fe2+, Co2+, Ni2+.
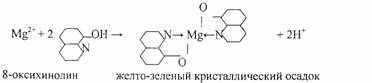
4.Реакция с 8- оксихинолином.
Реакцию проводят в аммиачной среде при рН = 8—13 (при нагревании).
Осадок растворим в минеральных кислотах и в уксусной кислоте. Проведению реакции мешают катионы, также образующие комплексы с 8 -оксихинолином (Cu2+, Zn2+. Cd2+, Fe3+ и др.).
5. Реакция с хинализарином.
Реакцию проводят в щелочной среде. Образуется синий осадок комплексного соединения – хинализарината магния состава MgL(OH), где НL – условное обозначение молекулы хинализарина:
При небольшом содержании катионов Mg2+в растворе осадок не выпадает, а раствор окрашивается в цвет. Проведению реакций мешают катионы алюминия.
6. Реакция с растворимыми карбонатами (Nа2С03).
2 Mg2++ 2 Nа2С03 + Н2О = (МgОН)2С0з (белый аморфный) +4 Nа + СО2. Осадок (МgОН)2С0з,растворим в кислотах и в солях аммония.
7. Реакция с оксалатом аммония (NH4)С2О4.
Mg2++ (NH4)С2О4 = Mg С2О4 (белый) + 2 NH4
8. Катионы Mg2+ с дифенилкарбазидом (С6Н5 NHNH)2С0 образуют комплекс красно— фиолетового цвета.
Смотрите также
Применение информационных технологий в процессе обучения химии
Известно, что образование — один из главных институтов социализации личности. Главная цель образования — формирование свободной, ответственной, гуманной личности, способной к дальнейшему сам .
http://www.km.ru/referats/0F6B94488AC347398E3F2CF25FBE2D75
http://www.chemicals-el.ru/chemicals-3968-1.html