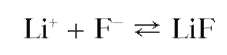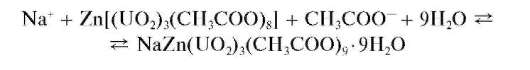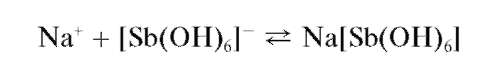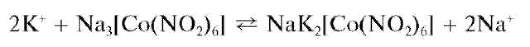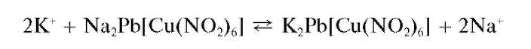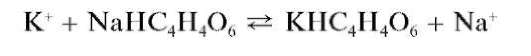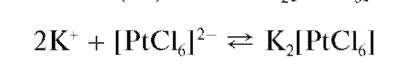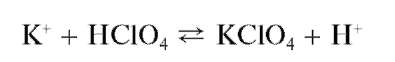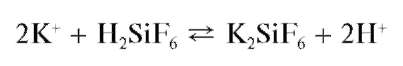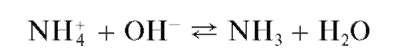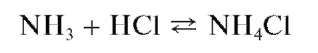Аналитические реакции катионов VI группы
8.1 Аналитические реакции катионов натрия Na +
1.Микрокристаллоскопическая реакция с уранилацетатом UO2(CH3COO)2. Каплю исследуемого раствора наносят на предметное стекло, упаривают. Затем помещают на это же стекло каплю раствора уранилацетата в уксусной кислоте. Выпадают зеленовато-желтые или бесцветные кристаллы уранилацетата натрия:
Рис.8.1. Кристаллы уранилацетата натрия NaUO2(CH3COO)3 под микроскопом.
Чувствительность реакции повышается в присутствии солей цинка. В данном случае реакция протекает согласно уравнению:
Данной реакции мешают катионы K + , NH4 + , Mg 2+ , Ca 2+ , Sr 2+ , Ba 2+ , Cu 2+ , Zn 2+ , Cd 2+ , Hg 2+ , Al 3+ , Mn 2+ , Co 2+ , Ni 2+ , но в том случае, если их содержание в исследуемом растворе превышает 5 мг/мл.
На предметное стекло наносят каплю раствора хлорида натрия, слегка упаривают до начала образования белой каемки по краям капли и прибавляют каплю раствора уранилацетата (цинкуранилацетата). Через 2-3 минуты наблюдают под микроскопом образование желтых октаэдрических и тетраэдрических кристаллов (рис.8.1.).
8.2 Аналитические реакции катионов калия К +
Катионы аммония NH4 + мешают открытию катионов калия, поэтому их предварительно удаляют из раствора.
1.Катионы К + при взаимодействии с раствором Na3[Co(NO2)6] образуют желтый кристаллический осадок двойной соли:
Осадок лучше выпадает из концентрированных растворов в нейтральной или слабокислой (СН3СООН) среде. Из разбавленных растворов осадок выпадает медленно.
2.Микрокристаллоскопическая реакция с гексанитрокупратом (II) натрия и свинца Na2Pb[Cu(NO2)6]:
На предметное стекло наносят каплю раствора соли калия, осторожно упаривают над спиртовкой или электроплиткой до образования белой каемки по краям капли, охлаждают до комнатной температуры и прибавляют каплю раствора Na2Pb[Cu(NO2)6]. Через 1-2 мин наблюдают под микроскопом образование в жидкости черных кубических кристаллов (рис. 8.2).
3.Катионы К + при взаимодействии с гидротартратом натрия (натрия кислого виннокислого) NaHC4H4O6 в присутствии ацетата натрия образуют малорастворимый в воде гидротартрат калия, выпадающий в виде белого кристаллического осадка:
8.3 Аналитические реакции катионов аммония NH4 +
1.Действие щелочей. Соли аммония в растворах щелочей разлагаются при нагревании с выделением газообразного аммиака:
Выделяющийся аммиак обнаруживают с помощью индикаторной бумаги или по запаху.
2.Действие реактива Несслера на соли аммония. Реактив Несслера представляет собой водный раствор, содержащий соединения K2[HgI4] и КОН. Катионы аммония образуют с реактивом Несслера красно-бурый осадок, состав которого описывают формулами:
Реакция протекает согласно схеме:
Реакции мешают все катионы, дающие при реакции со щелочами окрашенные осадки (Cr 3+ , Fe 3+ , Co 2+ , Ni 2+ и другие), а также катионы, приводящие к разрушению реактива Несслера (Hg 2+ ).
Продукты основных аналитических реакций катионов шестой группы представлены в таблице 8.1.
Продукты некоторых аналитических реакций катионов VI группы
Частные реакции катионов первой аналитической группы
Читайте также:
|
| Ион | Реагент | Условия проведения реакции | Уравнение реакции в молекулярном и ионном виде | Внешний эффект реакции | Вывод |
Реакции обнаружения катиона калия К +
1. Гидротартрат натрия NaHC4H4O6,или винная кислота,в присутствии ацетата натрия при достаточной концентрации ионов калия К + в растворе дает белый кристаллический осадок гидротартрата калия:
Осадок растворяется в сильных кислотах и щелочах, поэтому реакцию проводят в нейтральной или слабокислой средах:
Реакцию следует проводить при охлаждении под струей водопроводной воды, так как растворимость осадка гидротартрата калия КНС4Н4О6 повышается при увеличении температуры.
Для ускорения выпадения осадка стенки пробирки потирают стеклянной палочкой для образования центров кристаллизации.
Реакция протекает при больших концентрациях ионов калия К + и является малочувствительной. Ионы аммония NH + 4 мешают определению ионов калия К + из-за того, что тоже дают белый кристаллический осадок с этими реагентами и поэтому соли аммония предварительно разлагают при нагревании.
Реакция является фармакопейной.
2. Гексанитрокобальтат (III) натрия Na3[Co(NO2)6] в нейтральном или слабокислом растворе с ионом калия К + дает желтый кристаллический осадок гексанитрокобальтата (III) калия-натрия:
В щелочной среде реакцию обнаружения К + проводить нельзя, так как в этой среде гексанитрокобальтат (III) натрия разлагается с образованием гидроксида кобальта (III) бурого цвета:
В сильных кислотах осадок K2Na[Co(NO2)6] растворяется с образованием нестойкой кислоты гексанитрокобальтата (III) водорода H3[Co(NO2)6].
Реакцию обнаружения ионов калия следует проводить в отсутствии ионов NH4 , так как последние дают аналогичный осадок с Na3[Co(NO2)6]. Рассматриваемая реакция обнаружения иона калия более чувствительна, чем реакция с гидротартратом натрия и является также фармакопейной.
3. Окрашивание пламени. При выполнении этой реакции платиновую проволочку, впаянную в стеклянную палочку, смачивают хлороводородной кислотой и вносят в бесцветное пламя горелки. Прокаливают до тех пор, пока окрашивание пламени не прекратится. Затем раскаленной проволокой касаются мелкого порошка или опускают ее в раствор соли калия и снова вносят в бесцветное пламя горелки. Если в образце или растворе присутствуют ионы калия, то пламя горелки окрашивается в фиолетовый цвет. Присутствие ничтожных следов натрия, окрашивающего пламя в желтый цвет, маскирует окраску.
Эта реакция используется при анализе фармацевтических препаратов.
Реакции обнаружения катиона натрия Na +
1. Гексагидроксостибиат калия K[Sb(OH)6] образует с ионом натрия белый кристаллический осадок гексагидроксостибиат (V) натрия:
Обнаружение иона Na + с помощью гексагидроксостибиата (V) калия проводят в нейтральном или слабощелочном растворе, так как кислоты разлагают реагент:
образуя белый аморфный осадок метасурьмяной кислоты. Щелочи растворяют осадок Na[Sb(OH)6] с образованием хорошо растворимой средней соли:
Соли аммония, дающие в результате гидролиза кислую реакцию среды, также разлагают исходный реактив с образованием метасурьмяной кислоты. Поэтому добиваются отсутствия в растворе ионов NH + 4 до определения в нем ионов К + .
Для образования центров кристаллизации и скорейшего выпадения осадка гексагидроксостибиата (V) натрия реакцию проводят при охлаждении и потирают стенки пробирки стеклянной палочкой.
2. Микрокристаллоскопическая реакция. Ацетат уранила UO2(CH3COO)2 образует в уксуснокислой среде с солями натрия желтоватые кристаллы уранилацетата натрия Na[(UO2)(CH3COO)3]:
При выполнении реакции раствор соли натрия выпаривают досуха и обрабатывают ацетатом уранила. Выпавшие кристаллы имеют форму желтоватых тетраэдров (или октаэдров) под микроскопом ( рис. 8.1).
Рис. 8.1. Кристаллы уранилацетата натрия
Реакция используется в фармакопее.
3. Окрашивание пламени. Соли натрия окрашивают бесцветное пламя горелки в желтый цвет. Реакция очень характерна и является фармакопейной.
Установить присутствие натрия в исследуемом веществе по окрашиванию бесцветного пламени можно только тогда, когда желтая окраска пламени сохраняется 25-30 с.
Реакции обнаружения катиона аммония NH + 4
1. Щелочи NaOH и КОН разрушают аммонийные соли с выделением аммиака:
Выделяющийся аммиак можно обнаружить с помощью влажной красной или фиолетовой лакмусовой бумажки. Образующиеся по реакции
гидроксид-ионы ОН — изменяют окраску лакмуса в синий цвет. Подобную реакцию можно провести в газовой камере (см. рис. 7.8). При большой концентрации выделяющегося аммиака его можно обнаружить и по запаху. Реакция фармакопейная.
2. Реактив Несслера (смесь K2[HgI4] и КОН). Этот реактив дает с аммонийными солями красно-бурый осадок:
При очень малых количествах солей аммония вместо осадка образуется желтый раствор; при большом их количестве — осадок растворяется. Реакция очень чувствительна. Ионы калия и натрия не мешают определению ионов аммония.
Дата добавления: 2014-11-13 ; просмотров: 58 ; Нарушение авторских прав
—>Аналитические группы катионов —>
I аналитическая группа: Li + ,Na + ,K + , NH4 +
Групповой реагент отсутствует.
Катионы первой аналитической группы Na + и K + являются катионами S 1 -элементов с электронной структурой благородного газа. Вследствие высокой полярности связи этих катионов с анионами, близкой к ионной, большинство их солей растворимо в воде. Особенно важна для анализа растворимость в воде их сульфидов, гидроксидов, карбонатов и хлоридов, что отличает первую группу катионов от всех остальных аналитических групп. Аналогично ведут себя и соли аммония.
Аналитические реакции катиона лития Li +
Реакция с двузамещенным гидрофосфатом натрия Na2HPO4. Гидрофосфат натрия Na2HPO4 в нейтральной или слабощелочной среде образует с катионами лития белый осадок фосфата (ортофосфата) лития Li 3 PO 4:
Для увеличения полноты осаждения при проведении реакции добавляют этанол, поскольку в водноэтанольной среде растворимость фосфата лития уменьшается. Фосфат лития растворим в растворах кислот и солей аммония. Реакцию проводят обычно в аммиачной среде для связывания выделяющихся ионов водорода. Предел обнаружения катионов лития данной реакцией составляет 5 мкг. Мешают все катионы, образующие нерастворимые (малорастворимые) в воде фосфаты.
Методика. В пробирку вносят
10 капель раствора соли лития, прибавляют столько же капель концентрированного раствора аммиака, несколько капель этанола и
15 капель раствора гидрофосфата натрия. Через
5 минут выпадает белый мелкокристаллический осадок, растворимый в уксусной кислоте. Большое количество этанола не следует прибавлять во избежание выделения осадка Na2HPO4.
Реакция с растворимыми карбонатами. Карбонат-ионы CO3 2 , — осаждают из водных нейтральных, щелочных (но не кислых!) растворов солей лития белый осадок карбоната лития Li2CO3:
Карбонат лития заметно растворим в воде, вследствие чего катионы лития осаждаются из раствора неполностью. Поэтому для проведения реакции используют концентрированные растворы солей лития и растворимых карбонатов. Реакцию предпочтительно проводить при нагревании, так как растворимость карбоната лития в воде уменьшается с ростом температуры. Карбонат лития растворяется в кислотах. Предел обнаружения
500 мкг. Мешают все катионы, образующие малорастворимые в воде карбонаты.
Методика. В пробирку вносят несколько капель концентрированного раствора соли лития, прибавляют примерно столько же концентрированного раствора соды Na2CO3 (или поташа K2CO3) и нагревают смесь. Выпадает белый мелкокристаллический осадок карбоната лития Li2CO3.
Реакция с растворимыми фторидами. Фторид-ионы досаждают из водных растворов солей лития белый осадок малорастворимого в воде фторида лития LiF:
Растворимость фторида лития в воде уменьшается в присутствии аммиака. Предел обнаружения — 50 мкг. Мешают катионы Mg 2+ ,Ca 2+ , Sr 2+ ,Ba 2+ ,Cu 2+ ,Pb 2+ , также дающие осадки фторидов.
Методика. В пробирку вносят 3-4 капли раствора соли лития, 1- 2 капли концентрированного аммиака и 4-5 капель раствора фторида аммония NH4F. Смесь нагревают. Медленно выпадает аморфный осадок фторида лития. Осадок растворяется в уксусной кислоте.
Окрашивание пламени газовой горелки. Соли лития окрашивают пламя газовой горелки в карминово-красный цвет.
Методика. На платиновой или нихромовой проволочке (или на кончике графитового стержня) вносят в пламя газовой горелки несколько кристалликов хлорида лития LiCl. Пламя окрашивается в карми-ново-красный цвет. Если пламя окрашивается в желтый цвет из-за присутствия следов катионов натрия, то его рассматривают через синее стекло или индиговую призму — склянку специальной призматической формы, заполненную раствором красителя — индиго (синее стекло и раствор индиго поглощают желтые лучи).
Некоторые другие реакции катионов лития. Катионы лития образуют со стеаратом аммония CH3(CH2)16COONH4малорастворимый осадок стеарата лития CH3(CH2)16COOLi, c цинкуранилацета-том Zn(UO2)3(CH3COO)8 — желто-зеленый осадок LiZn(UO2)3 (CH3COO)99H2O, с гексагидроксостибатом калия K[Sb(OH)6] —
Аналитические реакции катиона натрия Na +
Известно ограниченное число аналитических реакций катиона натрия.
Микрокристаллоскопическая реакция с цинкуранилацетатом (фармакопейная). Катионы натрия дают с цинкуранилацетатом Zn(UO2)3 (CH3COO)8 в уксуснокислом растворе желтый кристаллический осадок натрийцинкуранилацетата NaZn(UO2)3(CH3COO)9*9H2O, нерастворимый в уксусной кислоте:
Натрийцинкуранилацетат образует кристаллы октаэдрической и тетраэдрической формы, хорошо различимые при рассмотрении под микроскопом в капле раствора. Предел обнаружения — около 0,8 мкг; реакция высокочувствительна. Мешают катионы Li + ,K + , NH4 + ,Mg 2 +, Ca 2+ ,Sr 2+ ,Ba 2+ ,Cu 2+ ,Zn 2+ ,Cd 2+ ,Hg 2+ ,Al 3+ ,Mn 2+ ,Co 2+ ,Ni 2+ при их содержании более 5 мг в 1 мл раствора.
Методика. На предметное стекло наносят каплю раствора NaCl, слегка упаривают до начала образования белой каемки по краям капли и прибавляют каплю раствора цинкуранилацетата. Через 2-3 мин наблюдают под микроскопом образование желтых октаэдрических и тет-раэдрических кристаллов.
Микрокристаллоскопическая реакция с гексагидроксостибатом(У) калия. Катионы натрия образуют с гексагидроксостибатом(V) калия K[Sb(OH)6] в нейтральном (рН = 7) растворе белый мелкокристаллический осадок гексагидроксостибата(V) натрия Na[Sb(OH)6]:
Из разбавленных растворов осадок выпадает медленно или вообще не выпадает. В сильно щелочной среде осадок не образуется, а из сильно кислых растворов выделяется белый аморфный осадок метасурьмяной кислоты HSbO3, который можно ошибочно принять за осадок гексагидроксостибата натрия. Поэтому образование белого осадка само по себе еще недостаточно для вывода о присутствии катионов натрия; необходимо при рассмотрении под микроскопом убедиться в том, что этот осадок — кристаллический. Реакцию проводят на холоду.
В присутствии нитрат-ионов выделение осадка замедляется.
Реакция малочувствительна и удается лишь при больших концентрациях катионов натрия. Мешают катионы лития, аммония, магния.
Методика. На предметное стекло наносят каплю концентрированного раствора NaCl и одну каплю раствора гексагидроксостибата(У) калия. Через 3-5 минут наблюдают под микроскопом образование кристаллов.
Окрашивание пламени газовой горелки соединениями натрия (фармакопейный тест). Соли и другие соединения натрия окрашивают пламя газовой горелки в желтый цвет. Реакция высокочувствительна. Открываемый минимум составляет 110 -4 мкг.
Методика. На кончике графитового стержня (или на нихромовой либо платиновой проволочке) вносят в пламя газовой горелки несколько кристалликов соли натрия (например, NaCl). Пламя окрашивается в ярко-желтый цвет. Окраска не исчезает в течение нескольких секунд.
Аналитические реакции катиона калия K +
Наиболее часто катионы калия открывают реакциями с гексанитрокобальтатом(Ш) натрия Na3[Co(NO2)6], с гексанитрокупратом(II) натрия и свинца Na2Pb[Cu(NO2)6], с гидротартратом натрия NaHC4H4O6 и по фиолетовому окрашиванию пламени газовой горелки.
Катионы аммония NH4 + , как правило, мешают открытию катионов калия, поэтому перед открытием катионов калия их необходимо предварительно удалить, если они присутствуют в анализируемом растворе.
Реакция с гексанитрокобальтатом(III) натрия (фармакопейная). Катионы калия в достаточно концентрированных растворах в уксуснокислой (рН = 3) или нейтральной среде образуют с растворимым в воде Na3[Co(NO2)6] желтый кристаллический осадок гексанитрокобальтата(III) натрия и калия NaK2[Co(NO2)6]:
Из разбавленных растворов осадок выпадает медленно, при стоянии раствора. В сильно кислой среде образуется нестойкая, быстро разлагающаяся кислота H3[Co(NO2)6]. В щелочной среде выпадает бурый осадок гидроксида кобальта(Ш) Co(OH)3.
Для проведения реакции используют свежеприготовленный водный раствор Na3[Co(NO2)6], так как со временем этот реагент разлагается. Потирание стеклянной палочкой стенок пробирки ускоряет формирование осадка (NaK2[Co(NO2)6] склонен к образованию пересыщенных растворов). В присутствии катионов серебра Ag+ выпадает еще менее растворимый осадок состава K2Ag[Co(NO2)6], поэтому наличие катионов серебра в растворе повышает чувствительность реакции.
Предел обнаружения — 4 мкг; предельное разбавление — 13-10 3 мл/г. Мешают катионы Li + , NH 4 + , также образующие желтые осадки.
Методика. В пробирку вносят 2 капли концентрированного раствора соли калия и 2 капли свежеприготовленного концентрированного раствора Na3[Co(NO2)6]. Выпадает желтый осадок NaK2[Co(NO2)6]. Если осадок не образуется, то потирают стенки пробирки стеклянной палочкой.
Микрокристаллоскопическая реакция с гексанитрокупратом(II) натрия и свинца. Катионы калия в нейтральной среде образуют с гексанитрокупратом(II) натрия и свинца Na2Pb[Cu(NO2)6] черные кристаллы гексанитрокупрата(II) калия и свинца K2Pb[Cu(NO2)6]кубической формы, хорошо видимые под микроскопом:
Реакция высокочувствительна: открываемый минимум — 0,15 мкг, предельное разбавление — 6,6-10 3 мл/г. Мешают катионы NH4 + ,Rb + , Cs + , также дающие черный осадок с реактивом.
Методика. На предметное стекло наносят каплю раствора соли калия, осторожно упаривают над пламенем газовой горелки до образования белой каемки по краям капли, охлаждают до комнатной температуры и прибавляют каплю раствора Na2Pb[Cu(NO2)6]. Через 1-2 мин наблюдают под микроскопом образование в жидкости черных кубических кристаллов.
Реакция с гидротартратом натрия (фармакопейная). Катионы калия при реакции с гидротартратом натрия NaHC4H4O6(или с винной кислотой H2C4H4O6 в присутствии ацетата натрия CH3COONa) в нейтральной среде образуют малорастворимый в воде гидротартрат калия KHC4H4O6, выпадающий в виде белого кристаллического осадка:
Образование осадка ускоряется при потирании стенок пробирки стеклянной палочкой.
Осадок растворяется в кислотах с образованием винной кислоты и в щелочах — с образованием средних тартратов, например, среднего тартрата калия K2C4H4O6.
Предел обнаружения — около 50 мкг, предельное разбавление
10 3 мл/г. Мешают катионы NH4 + , образующие осадок состава NH4HC4H4O6, а также катионы Rb + ,Cs + .
Реакцию можно проводить микрокристаллоскопически.
Методика. В пробирку вносят 2-3 капли раствора соли калия, 2 капли раствора гидротартрата натрия и потирают стенки пробирки стеклянной палочкой. Через некоторое время образуется белый кристаллический осадок.
Окрашивание пламени газовой горелки (фармакопейный тест). Соли и другие соединения калия при внесении их в пламя газовой горелки окрашивают его в фиолетовый цвет.
Методика. На кончике графитового стержня (или нихромовой либо платиновой проволочки) вносят в пламя газовой горелки кристаллики хлорида калия (или другой соли калия). Наблюдается окрашивание пламени в фиолетовый цвет.
Другие аналитические реакции катионов калия.
С гексахлороплатинатом(IV) натрия Na2[PtCl6] и соответствующей кислотой H2[PtCl6] катионы калия образуют желтый кристаллический осадок гексахлороплатината(IV) калия K2[PtCl6]:
Предел обнаружения — около 25 мкг. Мешают катионы NH4 4 , также дающие желтый осадок гексахлороплатината аммония (NH4)2[PtCl6].
С хлорной кислотой HClO4 катионы K+ выделяют белый кристаллический осадок перхлората калия KClO4:
С кремнефтороводородной кислотой H2SiF6 в нейтральной среде катионы K+ образуют студенистый осадок гексафторосиликата калия
Катионы аммония не мешают этой реакции.
Аналитические реакции катиона аммония NH4 +
Реакция разложения солей аммония щелочами (фармакопейная) .Соли аммония в растворах щелочей разлагаются с выделением газообразного аммиака:
Выделяющийся газообразный аммиак обнаруживают с помощью влажной красной лакмусовой бумаги (синеет в парах аммиака), влажной фенолфталеиновой бумаги (в парах аммиака окрашивается в малиновый цвет) или стеклянной палочки, кончик которой смочен концентрированной хлороводородной кислотой — в парах аммиака наблюдается образование белого дыма хлорида аммония:
Реакция специфична и высокочувствительна: предел обнаружения равен 0,01 мкг, предельная концентрация —
2-10 7 г/мл ,предельное разбавление —
Методика. В пробирку вносят 8-10 капель раствора соли аммония, прибавляют такой же объем раствора NaOH и осторожно нагревают раствор, не допуская его кипения и разбрызгивания. Над раствором помещают влажную красную лакмусовую бумагу, не касаясь ею стенок пробирки во избежание попадания на бумагу капелек щелочного раствора. Выделяющиеся пары аммиака окрашивают красную лакмусовую бумагу в синий цвет.
Реакция с реактивом Несслера — смесью раствора тетрайодомерку-рата(П) калия K2[HgI4] c KOH (фармакопейная).Катионы аммония образуют с реактивом Несслера аморфный красно-бурый осадок. Чаще всего состав этого осадка описывают формулами
Реакция высокочувствительна: предел обнаружения — 0,05-0,25 мкг, предельный объем
0,05 мл. Позволяет открывать следы катионов аммония — наблюдается окрашивание раствора в желтый или бурый цвет. Мешают все катионы, дающие со щелочами окрашенные осадки (Cr 3+ ,Fe 3+ ,Co 2+ ,Ni 2+ и др.) или разлагающие реактив Несслера (Hg 2 +, Sn 2+ ,Sb 3+ ).
Методика. К 1-2 каплям раствора соли аммония прибавляют
2 капли реактива Несслера. Выпадает аморфный красно-бурый осадок.
Другие аналитические реакции катионов аммония. Катионы аммония в растворе образуют с Na3[Co(NO2)6^H2[PtCl6] желтые осадки соответственно (NH4)2Na[Co(NO2)6] и (NH4)2[PtCl6]; с гидротартратом натрия NaHC4H4O6 — белый осадок гидротартрата аммония NH4HC4H4O6;cNa2Pb[Cu(NO2)6] — черный осадок, что может помешать открытию катионов калия. Катионы аммония мешают также открытию катионов натрия.
Перед открытием катионов натрия и калия удаляют катионы аммония, если они присутствуют в анализируемом растворе.
http://lektsii.com/1-6402.html
http://analitica.ucoz.com/index/i_analiticheskaja_gruppa_kationov/0-12