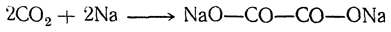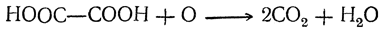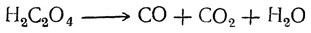Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Щавелевая кислотаЩавелевая кислота образуется часто при окислении, различных органических веществ. Раньше ее получали окислением древесных опилок кислородом воздуха при нагревании их с расплавленными едкими щелочами. При этом для прохождения реакции обязательно требуется присутствие хотя бы небольшого количества едкого кали; с чистым едким натром получение щавелевой кислоты невозможно. Окисление сахара азотной кислотой в присутствии пятиокиси ванадия как катализатора применяется и теперь для технического получения щавелевой кислоты (отсюда и произошло в свое время название этой кислоты — «сахарная соль»). Другой промышленный способ получения щавелевой кислоты основан на том, что при быстром нагревании до 360° С формиат натрия (а также калия) отщепляет водород, превращаясь в оксалат натрия. Так как формиат натрия получается из окиси углерода и едких щелочей, то практически щавелевую кислоту можно получить непосредственно из этих веществ. Существует много способов получения щавелевой кислоты, представляющих теоретический интерес. Например, при взаимодействии щелочных металлов с углекислым газом при 360° С получается соль щавелевой кислоты: При кристаллизации из воды щавелевая кислота обыкновенно получается в виде гидрата С2Н2О4 ∙ 2Н2О. Этот гидрат начинает диссоциировать уже выше 30° С. При очень быстром нагревании он плавится при 101,5° С. Безводная кислота в виде ромбических октаэдров может быть получена кристаллизацией из 70%-ной серной кислоты, а также высушиванием при осторожном нагревании (лучше — в вакууме). При возгонке щавелевая кислота получается в двух кристаллических формах: при низких температурах в вакууме — иглы, при более высоких — октаэдры. Безводная кислота плавится при 180° С с разложением. На этом основано применение щавелевой кислоты и ее солей как восстановителей, а также использование ее в анализе для установления титра растворов перманганата. При нагревании щавелевая кислота разлагается (особенно легко в присутствии концентрированной серной кислоты) на окись углерода, углекислоту и воду: Таким образом, теоретически возможный ангидрид щавелевой кислоты оказывается неспособным к существованию. Щавелевая кислота как двухосновная дает кислые и средние соли (оксалаты). Известны также и молекулярные соединения кислых оксалатов со щавелевой кислотой («тетраоксалаты»), как, например, кисличная соль КНС2О4 ∙ Н2С2О4 ∙ 2Н2О, употребляемая для выведения чернильных пятен. Из солей щавелевой кислоты растворимы в воде лишь соли щелочных металлов. Щавелевокислый кальций нерастворим в воде и уксусной кислоте, но растворим в соляной кислоте; эти его свойства используются в качественном и количественном анализе для определения кальция. При обыкновенной температуре он кристаллизуется с одной молекулой воды, при более низких температурах — с тремя молекулами воды. Щавелевая кислота легко дает комплексные соли, например K2[Fe(C2O4)2] и K3[Fe(C2O4)3]. В растворах этих солей содержатся комплексные ионы — двухзарядный ион Fe(C2O4)2 2– и трехзарядный ион Fe(C2O4)3 3– . Растворы первой из указанных солей имеют желтый цвет; эта соль применяется в качестве проявителя в фотографии. Растворы второй соли окрашены в зеленый цвет. Уравнение реакции нагревания щавелевой кислоты
С целью установления причин такого явления рассмотрим процессы, происходящие при нагревании щавелевой кислоты. В первую очередь происходит разрушение входящего в состав технической кислоты кристаллогидрата, который плавится при температуре 101,5 о С (чистая кислота — при 189 о С). При 200 о С щавелевая кислота разлагается с образованием муравьиной кислоты и углекислого газа. При более высокой температуре, что часто имеет место при работе на пасеках с использованием простых, нерегулируемых способов нагрева (примуса, паяльной лампы, раскаленных углей), происходит деструкция муравьиной кислоты до воды и окиси углерода (угарного газа). Так как окись углерода—токсичное вещество, то, возможно, ее действие и есть одна из причин гибели маток или ухудшения их качества, приводящих к тихой смене. Разложение образующейся муравьиной кислоты до воды и окиси углерода можно избежать, если проводить нагрев щавелевой кислоты в глицерине, которая образует с ним моноглицерооксалат, легко декарбоксилирующийся с образованием моноформина и углекислого газа. Моноформин при избытке щавелевой кислоты образует снова моноглицерооксалат с выделением муравьиной кислоты. Температура кипения муравьиной кислоты 101 о С, и она испаряется не перегреваясь. Из-за наличия в реакционной среде воды моноформин частично гидролизуется до глицерина, который вновь принимает участие в реакции со следующим количеством щавелевой и муравьиной кислот. Массовое соотношение исходных компонентов в реакционной смеси примерно одинаковое. Уменьшение количества глицерина и возможный перегрев реакционной массы, вероятность которого мала вследствие испарения образующихся высоколетучих веществ (воды, муравьиной кислоты), могут привести к дегидратации глицерина с образованием акролеина — непредельного альдегида, обладающего лакриматорным (слезоточивым) действием. Таким образом, используя реакцию образования сложного эфира из глицерина и щавелевой кислоты с последующей его деструкцией, можно обработать большое число пчелиных семей образующейся муравьиной кислотой, значительно уменьшив вероятность ее разложения до высокотоксичной окиси углерода, приводящей к гибели маток, снижению их продуктивности или склонности пчел к их смене. Военный университет радиационной, Аннотация: источники: http://xumuk.ru/organika/275.html http://beejournal.ru/borba-s-boleznyami-i-vreditelyami/905-prevrashcheniya-shchavelevoj-kisloty-pri-nagrevanii |