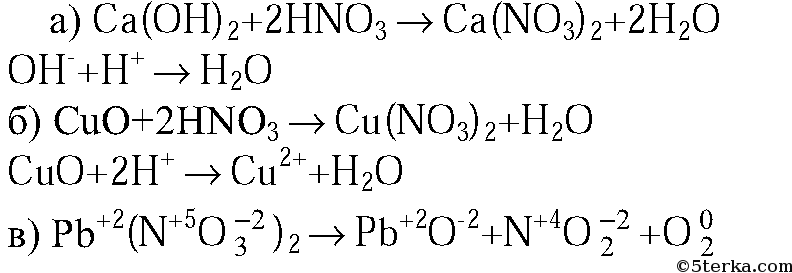Нитрат кальция: способы получения и химические свойства
Нитрат кальция Ca(NO3)2 — соль щелочного металла кальция и азотной кислоты. Белый, при нагревании разлагается. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 164,09; относительная плотность для тв. и ж. состояния d = 2,36; tпл = 561º C (разлагается).
Способ получения
1. Нитрат кальция можно путем взаимодействия кальция и разбавленной азотной кислоты, образуется нитрат кальция, оксид азота (I) и вода:
если кальций будет взаимодействовать с очень разбавленной азотной кислотой , то на выходе будет образовываться нитрат кальция, нитрат аммония и вода:
2. В результате взаимодействия сульфида кальция и концентрированной азотной кислоты образуется нитрат кальция, сера, оксид азота (IV) и вода:
Качественная реакция
Качественная реакция на нитрат кальция — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат кальция образует сульфат кальция, нитрат меди, бурый газ оксид азота и воду:
Химические свойства
1. Hитрат кальция разлагается при температуре 450 — 500º С с образованием нитрита кальция и кислорода:
а если температуре поднимется выше 561 о С, то на выходе реакции будут образовываться оксид кальция, оксид азота (IV) и кислород:
2. Нитрат кальция реагирует с простыми веществами :
2.1. Нитрат кальция вступает в реакцию с атомным водородом (цинком и в присутствии соляной кислоты). В результате реакции образуется нитрат кальция и вода :
3. Возможны реакции между нитратом кальция и сложными веществами :
Нитрат кальция вступает в реакцию с cолями :
В результате реакции между нитратом кальция и гидрофосфатом натрия при кипении образуется фосфат кальция, азотная кислота и нитрат натрия:
Составьте молекулярные, полные и сокращенные ионные уравнения реакций между растворами : 1)хлорида аммония и гидроксида кальция 2)Сульфата аммония и нитрата бария 3)Нитрата аммония и гидроксида натрия?
Химия | 5 — 9 классы
Составьте молекулярные, полные и сокращенные ионные уравнения реакций между растворами : 1)хлорида аммония и гидроксида кальция 2)Сульфата аммония и нитрата бария 3)Нитрата аммония и гидроксида натрия.
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
2NH4⁺ + 2Cl⁻ + Ca²⁺ + 2OH⁻ = Ca²⁺ + 2Cl⁻ + 2NH3 + 2H2O
2NH4⁺ + 2OH⁻ = 2NH3 + 2H2O
NH4⁺ + OH⁻ = NH3 + H2O
(NH4)2SO4 + Ba(NO3)2 = BaSO4 + 2NH4NO3
2NH4⁺ + SO4²⁻ + Ba²⁺ + 2NO3⁻ = BaSO4 + 2NH4⁺ + 2NO3⁻
NH4NO3 + NaOH = NaNO3 + NH3 + H2O
NH4⁺ + NO3⁻ + Na⁺ + OH⁻ = Na⁺ + NO3⁻ + NH3 + H2O
NH4⁺ + OH⁻ = NH3 + H2O.
Запишите уравнения реакций в молекулярной, полной ионной и сокращенной ионной формах между следующими веществами : 1?
Запишите уравнения реакций в молекулярной, полной ионной и сокращенной ионной формах между следующими веществами : 1.
Гидроксид бария и сульфит натрия 2.
Хлорид кальция и гидроксид калия 3.
Нитрат аммония и гидроксид натрия 4.
Оксид серы (VI) и гидроксид кальция.
Составьте молекулярное, полное ионное и сокращенное ионное уравнение реакции между сульфатом аммония и гидроксидом калия?
Составьте молекулярное, полное ионное и сокращенное ионное уравнение реакции между сульфатом аммония и гидроксидом калия.
Ребят, такой вопрос?
Ребят, такой вопрос.
Как понять какому взаимодействию соответствует сокращенное ионное уравнение?
Не могу с этим разобраться( Объясните на примере : NH4 + OH = NH3 + H20 1) хлорид аммония и воды 2) сульфата аммония и гидроксида натрия 3) нитрат аммония и гидроксид бария 4) раствор аммиака и гидроксид магния 5) карбонат аммония и хлороводород.
Сокращенному ионному уравнению : NH₄⁺ + OH⁻⇒NH₃ + H2O соответствует взаимодействие между : а) растворами аммония и гидроксида натрия б)растворами цитрата калия и гидроксида бария в)раствором сульфата ?
Сокращенному ионному уравнению : NH₄⁺ + OH⁻⇒NH₃ + H2O соответствует взаимодействие между : а) растворами аммония и гидроксида натрия б)растворами цитрата калия и гидроксида бария в)раствором сульфата аммония и гидроксидом меди (2) г) растворами карбоната аммония и гидроксида калия.
Напишите полные и сокращенные ионные уравнения реакций между растворами : а)сульфата алюминия и гидроксида калия?
Напишите полные и сокращенные ионные уравнения реакций между растворами : а)сульфата алюминия и гидроксида калия.
Б)фосфорной кислоты и хлорида кальция.
В)сульфата натрия и нитрата бария.
Уравнение реакции в молекулярном и ионном виде : карбонат аммония + соляная кислота ; сульфат аммония + гидроксид натрия ; сульфид аммония + сульфат магния ; ортофосфат аммония + хлорид бария ?
Уравнение реакции в молекулярном и ионном виде : карбонат аммония + соляная кислота ; сульфат аммония + гидроксид натрия ; сульфид аммония + сульфат магния ; ортофосфат аммония + хлорид бария ;
Срочно напишите уравнение реакций в молекулярной и ионной формах 1) гидроксид натрия + хлорид аммония 2) хлорид бария + сульфат натрия?
Срочно напишите уравнение реакций в молекулярной и ионной формах 1) гидроксид натрия + хлорид аммония 2) хлорид бария + сульфат натрия.
Необратимо протекает реакция ионного обмена между растворами : 1) соляной кислоты и нитрата серебра 2) сульфата цинка и хлорида калия 3) нитрата бария и хлорида аммония 4) гидроксида натрия и сульфата?
Необратимо протекает реакция ионного обмена между растворами : 1) соляной кислоты и нитрата серебра 2) сульфата цинка и хлорида калия 3) нитрата бария и хлорида аммония 4) гидроксида натрия и сульфата лития.
Составьте молекулярную, полную и сокращенную реакцию1)хлорида аммония и гидроксида кальция2)сульфата аммония и нитрата бария?
Составьте молекулярную, полную и сокращенную реакцию
1)хлорида аммония и гидроксида кальция
2)сульфата аммония и нитрата бария.
Как сделать ионное и сокращенное ионные уравнение из нитрата аммония и гидроксида натрия?
Как сделать ионное и сокращенное ионные уравнение из нитрата аммония и гидроксида натрия.
На этой странице сайта размещен вопрос Составьте молекулярные, полные и сокращенные ионные уравнения реакций между растворами : 1)хлорида аммония и гидроксида кальция 2)Сульфата аммония и нитрата бария 3)Нитрата аммония и гидроксида натрия? из категории Химия с правильным ответом на него. Уровень сложности вопроса соответствует знаниям учеников 5 — 9 классов. Здесь же находятся ответы по заданному поиску, которые вы найдете с помощью автоматической системы. Одновременно с ответом на ваш вопрос показаны другие, похожие варианты по заданной теме. На этой странице можно обсудить все варианты ответов с другими пользователями сайта и получить от них наиболее полную подсказку.
4 — оба суждения верны.
Держи реакции на здоровье )).
C4H10 — — >C4H8 + H2 C4H8 + H2O — — >C4H9OH C4H9OH +
Дано n(Ca) = 0. 1 mol V(H2O) = 200 mL = 0. 2 L — — — — — — — — — — — — — — — — — — — — — W(Ca(OH)2) — ? N(H2O) = V / Vm = 0. 2 / 22. 4 = 0. 001 mol n(Ca) > n(H2O) m(H2O) = V(h2O) * p(H2O) = 200 * 1 = 200 g 200 X Ca + 2H2O — — >Ca(OH)2 + H2 M(h2..
Заранее извиняюсь за качество фото.
1)аг (точно оба подходят) 2)а 3)ав 4)вг 5)а 6)а 7)а 8)г 9)г 10) не понятно в сколько молярном(число).
Под кетоновыми телами подразумевают группу продуктов метаболизма, образующихся в результате обмена основных нутриентов : углеводов, жиров и белков. Последние трансформируются с образованием вещества под названием ацетил — КоА (через гликолиз, бета -..
Вариант 2
Вопросы:
1. Напишите молекулярные и ионные уравнения реакций между раствором азотной кислоты и: а) гидроксидом кальция; б) оксидом меди(II); в) карбонатом бария.
2. Напишите уравнение реакции разложения нитрата свинца при нагревании. Укажите степени окисления элементов и расставьте коэффициенты с помощью метода электронного баланса.
3. В трех пронумерованных пробирках находятся кристаллические вещества: нитрат натрия, сульфат натрия и нитрат аммония. Как их можно распознать? Напишите уравнения соответствующих реакций.
Ответы и решения:
3. Данные вещества можно распознать при помощи растворов нитрата бария

задача №2
к главе «Тема III. Подгруппа азота. Работа 2. Азотная кислота и ее соли».
http://himia.my-dict.ru/q/1517101_sostavte-molekularnye-polnye-i-sokrasennye-ionnye/
http://5terka.com/node/11423