Реакция взаимодействия нитрата серебра (I) и железа
Реакция взаимодействия нитрата серебра (I) и железа
Уравнение реакции взаимодействия нитрата серебра (I) и железа:
Реакция взаимодействия нитрата серебра (I) и железа.
В результате реакции образуются нитрат железа (II) и серебро.
Реакция протекает при нормальных условиях.
Формула поиска по сайту: 2AgNO3 + Fe → Fe(NO3)2 + 2Ag.
Реакция взаимодействия оксида ванадия (III) и оксида цинка (II)
Реакция взаимодействия полигидрата оксида железа (III) и водорода
Реакция взаимодействия гидрокарбоната магния и гидроксида кальция
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Уравнение реакции нитрата серебра и железа
Составьте уравнения указанных реакций, используя химические формулы веществ из п. 6.1.
Ниже даны описания двух химических превращений с участием веществ, перечень которых был приведён в задании 6:
(1) железо + нитрат серебра → нитрат железа(II) + серебро;
(2) гидроксид бария + серная кислота → сульфат бария + вода.
В зависимости от числа и состава веществ, вступающих в химическую реакцию и образующихся в результате неё, различают реакции соединения, разложения, замещения и обмена. Выберите ЛЮБУЮ реакцию (1) или (2) и укажите её тип.
1. Реакция (1) — реакция замещения (атомы железа замещают атомы серебра в составе сложного вещества — нитрата серебра).
2. Реакция (2) — реакция обмена (два сложных вещества (гидроксид бария и серная кислота) обмениваются своими составными частями (ионами), в результате чего образуются два других сложных вещества — сульфат бария и вода).
Из приборов, изображённых на рисунках, выберите тот, с помощью которого можно разделить смесь железных опилок и порошка сульфата бария. Какой метод разделения веществ при этом используется? Почему прибор, изображённый на другом рисунке, не может быть использован для разделения смеси железных опилок и сульфата бария?
Разделить смесь железных опилок и сульфата бария можно действием магнита (рисунок 2). Прибор, изображённый на рисунке 1, используется для отделения примесей, нерастворимых в жидкости; поскольку и железные опилки, и сульфат бария представляют собой твёрдые вещества, они не могут быть разделены с помощью этого прибора.
Ответ: 2, действие магнитом.
1.
2.
Окисление сульфата железа(II) нитратом серебра
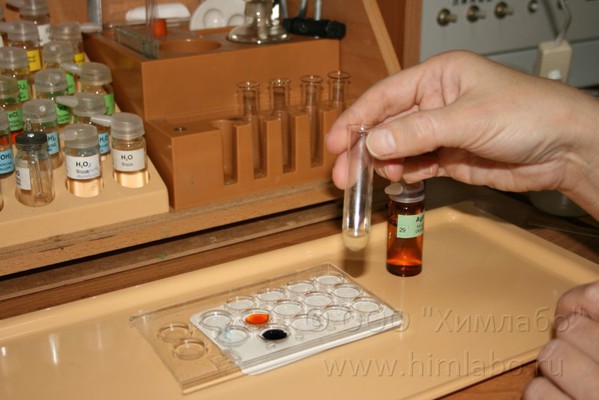
При проведении опыта используем Микролабораторию для химического эксперимента
Оборудование: планшетка, фоновый экран, пробирка (2 шт.), стеклянная палочка, фильтровальная бумага, воронка, спиртовка, зажим пробирочный, спички.
Реактивы: 10% раствор сульфата железа(II) FeSO4, 1% раствор нитрата серебра (I), раствор гексацианоферрата(III) калия K3[Fe(CN)6], раствор роданида калия KSCN (или роданида аммония NH4SCN).
В опыте используют свежеприготовленные растворы сульфата железа(II) и нитрата серебра (I). Причем раствор сульфата железа не желательно подкислять серной кислотой, т.к. в противном случае реакция гидролиза не идет до конца и бурый осадок не образуется, раствор просто приобретает слегка бурую окраску.
Данный опыт можно использовать для создания проблемных ситуаций: первая — протекание окислительно-восстановительной реакции вместо реакции ионного обмена, а вторая — образование бесцветного раствора соли железа (III), который только в результате гидролиза будет приобретать бурую окраску.
Ход работы
1. Устанавливают планшетку на белую сторону фонового экрана.
2. В две ячейки планшетки вносят по 5-6 капель сульфата железа(II).
3. В одну ячейку добавляют 5-6 капель гексацианоферрата(III) калия. Образуется темно-синий осадок (турнбулева синь). В другую ячейку планшетки добавляют 5-6 капель роданида калия, может появиться небольшое кирпичное окрашивание из-за следов ионов железа(III), если при приготовлении раствора использовали старый реактив.
4. В пробирку наливают 25 капель сульфата железа(II) и приливают к нему раствор нитрата серебра(I) до образования и осаждения мелкодисперстного серебристо-серого осадка серебра.
3FeSO4 + 3AgNO3=Fe2(SO4)3 + 3Ag↓ + Fe(NO3)3
5. Стеклянной палочкой переносят несколько капель получившегося раствора в планшетку
6. Добавляют 1 каплю раствор роданида калия KSCN. Наблюдают ярко-красное окрашивание вследствие образования роданида железа (III).Если реакция пройдет до конца, то при проведении аналогичной реакции с гексацианоферратом(III) калия, качественной реакции не наблюдают.
7. Полученный раствор соли железа (III) отфильтровывают от осадка серебра в пробирку.
8. Пробирку вставляют в пробирочный зажим и нагревают на спиртовке.
9. При нагревании раствор приобретает коричневую окраску, затем она усиливается, а потом выпадает бурый осадок.
После проведения данного опыта создаются сразу две проблемные ситуации. Первая заключается в том, что наблюдается реакция, которая, по представлениям учеников, протекать не должна. Ведь учащимся известно, что реакция между растворами солей возможна, если в результате взаимодействия образуется новая малорастворимая соль, выпадающая в осадок. В этом опыте в осадок выпадает не соль, а металл. Составляют уравнения окислительно-восстановительных реакций.
Далее обращают внимание на цвет раствора, образовавшегося в результате реакции. По представлениям учащихся, растворы солей железа (III) имеют желто-коричневую окраску, но полученный раствор окраски не имеет. Учащиеся должны сделать вывод о том, что свежеприготовленный раствор соли железа (III) окраски не имеет, цвет обычных растворов обусловлен гидролизом. Опираясь на уравнения реакций гидролиза по отдельным ступеням, учащиеся должны определить, что при нагревании гидролиз значительно усиливается и даже сопровождается выпадением осадка Fe3O3•nH2O.
Оказываем содействие в подготовке технических требований для тендерной документации.
Внимание! Изображение товара может отличаться от полученного Вами товара. Производитель оставляет за собой право изменять комплектацию и технические характеристики товара без предварительного уведомления без ухудшения функциональных и качественных показателей. Информация о товаре носит справочный характер и не является публичной офертой, определяемой Статьей 437 ГК РФ.
Убедительная просьба, при покупке учебного оборудования согласовывать с менеджером важные для Вас характеристики, комплектацию и цену учебного оборудования.
http://chem8-vpr.sdamgia.ru/problem?id=946
http://www.himlabo.ru/experiments/okislenie-sulfata-zheleza-ii-nitratom-serebra