Сложные эфиры: способы получения и свойства
Сложные эфиры: способы получения, химические и физические свойства, строение.
| Сложные эфиры – это органические вещества, в молекулах которых углеводородные радикалы соединены через карбоксильную группу -СОО-, а именно R1-COOH-R2. |
Общая формула предельных сложных эфиров: СnH2nO2
Классификация сложных эфиров
По числу карбоксильных групп:
- сложные эфиры одноосновных карбоновых кислот — содержат одну карбоксильную группу -СОО-. Общая формула CnH2nO2.
| Например, метилформиат |
- сложные эфиры многоатомных спиртов — содержат две и более карбоксильные группы -СОО-.
| Например, тристеарат глицерина |
- Сложные эфиры многоосновных органических кислот.
Например, общая формула сложных эфиров двухосновных карбоновых кислот CnH2n-2O4
Номенклатура сложных эфиров
В названии сложного эфира сначала указывают алкильную группу, связанную с кислородом, затем кислоту, заменяя суффикс в названии кислоты (-овая кислота) на суффикс -оат.
| Название сложного эфира | Тривиальное название | Формула эфира |
| Метилметаноат | Метилформиат | HCOOCH3 |
| Этилметаноат | Этилформиат | HCOOC2H5 |
| Метилэтаноат | Метилацетат | CH3COOCH3 |
| Этилэтаноат | Этилацетат | CH3COOC2H5 |
| Пропилэтаноат | Пропилацетат | CH3COOCH2CH2CH3 |
Химические свойства сложных эфиров
| Сложные эфиры устойчивы в нейтральной среде, но легко разлагаются при нагревании в присутствии кислот или в присутствии щелочей. |
В присутствии кислот гидролиз сложных эфиров протекает как реакция, обратная этерификации. при гидролизе сложных эфиров образуются спирты и карбоновые кислоты.
R-COO-R’ + H2O = R-COOH + R’-OH
Например , при гидролизе метилацетата образуются уксусная кислота и метанол.
При щелочном гидролизе сложных эфиров образуются соли карбоновых кислот и спирты.
Например , при щелочном гидролизе этилформиата образуются этанол и формиат натрия:
При щелочном гидролизе этилацетата образуются ацетат и этанол:
Щелочной гидролиз сложных эфиров — реакция, имеющая промышленное значение. Гидролиз жиров в присутствии оснований — древнейший способ получения мыла. Первые способы получения мыла связаны со смешиванием жира с золой. Один из основных компонентов животного жира — тристеарат глицерина. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:
2. Переэтерификация
Переэтерификация — это реакция превращения одного сложного эфира в другой под действием соответствующих спиртов в присутствии катализатора (кислоты или основания)
R-COO-CH3 + R’-OH = R-COOR’ + CH3-OH
3.Восстановление сложных эфиров
Сложные эфиры восстанавливаются с разрывом связи С-О карбоксильной группы. При этом образуется смесь спиртов.
| Например, этилбензоат восстанавливается литийалюминийгидридом до бензилового спирта и этанола |
Получение сложных эфиров
1. Этерификация карбоновых кислот спиртами
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2. Соли карбоновых кислот с галогеналканами
При взаимодействии солей карбоновых кислот с галогеналканами образуются сложные эфиры.
Этиловый эфир, свойства, структура, получение, использование
этиловый эфир, также известный как диэтиловый эфир, является органическим соединением, химическая формула которого C4H10О. Он характеризуется тем, что является бесцветной и летучей жидкостью, поэтому его бутылки должны быть как можно плотнее закрыты..
Этот эфир классифицируется как член диалкиловых эфиров; то есть они имеют формулу ROR ‘, где R и R’ представляют разные углеродные сегменты. И как он описывает свое второе имя, диэтиловый эфир, это два радикала-этила, которые связываются с атомом кислорода.
Первоначально этиловый эфир использовался в качестве общего анестетика, введенного в 1846 году Уильямом Томасом Грином Мортоном. Однако, из-за его воспламеняемости, его использование было отклонено, заменив его другими менее опасными анестетиками..
Это соединение также использовалось для оценки времени кровообращения, при оценке состояния сердечно-сосудистой системы пациентов..
В организме диэтиловый эфир может превращаться в углекислый газ и метаболиты; последние в конечном итоге выводятся с мочой. Однако большая часть вводимого эфира выдыхается в легких без каких-либо изменений..
С другой стороны, он используется в качестве растворителя для мыла, масел, парфюмерии, алкалоидов и камеди.
- 1 Структура этилового эфира
- 1.1 Межмолекулярные силы
- 2 Физические и химические свойства
- 2.1 Другие имена
- 2.2 Молекулярная формула
- 2.3 Молекулярный вес
- 2.4 Внешний вид
- 2.5 Запах
- 2.6 Вкус
- 2.7 Точка кипения
- 2.8 Точка плавления
- 2.9 Температура вспышки
- 2.10 Растворимость в воде
- 2.11 Растворимость в других жидкостях
- 2.12 Плотность
- 2.13 Плотность пара
- 2.14 Давление пара
- 2.15 Стабильность
- 2.16 Автоматическое зажигание
- 2.17 Разложение
- 2.18 Вязкость
- 2.19 Теплота сгорания
- 2.20 Тепло испарения
- 2.21 Поверхностное натяжение
- 2.22 Потенциал ионизации
- 2.23 Порог запаха
- 2.24 Показатель преломления
- 3 Получение
- 3.1 Из этилового спирта
- 3.2 Из этилена
- 4 Токсичность
- 5 использует
- 5.1 Органический растворитель
- 5.2 Общая анестезия
- 5.3 Дух эфира
- 5.4 Оценка кровообращения
- 5.5 Учебные лаборатории
- 6 Ссылки
Структура этилового эфира
На изображении выше мы имеем представление с моделью сфер и стержней молекулярной структуры этилового эфира.
Как видно, красная сфера, соответствующая атому кислорода, имеет две этильные группы, связанные с обеих сторон. Все звенья простые, гибкие и свободно вращаются вокруг осей σ.
Эти вращения происходят из стереоизомеров, известных как конформеры; что больше, чем изомеры, они являются альтернативными пространственными состояниями. Структура изображения точно соответствует антиконформеру, в котором все его группы атомов расположены в шахматном порядке (отделены друг от друга).
Каким был бы другой конформер? Затмение, и хотя ваше изображение недоступно, просто визуализируйте его с помощью формы U. На верхних концах U будут расположены метильные группы -CH3, которые будут испытывать стерические отталкивания (они сталкиваются в космосе).
Следовательно, ожидается, что молекула СН3СН2ОСН2СН3 принять анти-конформации большую часть времени.
Межмолекулярные силы
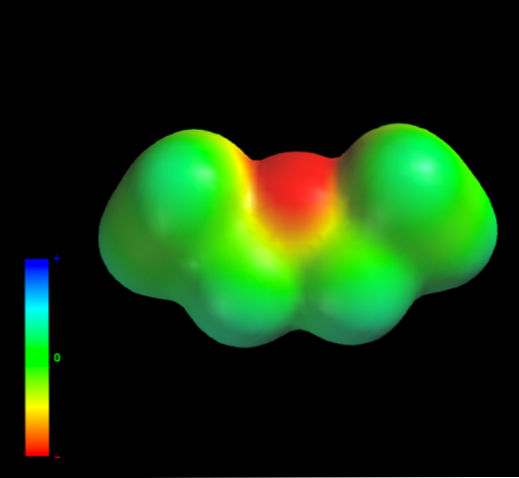
Какими межмолекулярными силами управляют молекулы этилового эфира в жидкой фазе? Они поддерживаются в жидкости главным образом благодаря дисперсионным силам, поскольку в их дипольном моменте (1,5D) отсутствует область, достаточно дефицитная по электронной плотности (δ +).
Это потому, что ни один атом углерода в этильных группах не дает слишком много электронной плотности для атома кислорода. Сказанное выше видно на карте электростатического потенциала этилового эфира под рукой (нижнее изображение). Обратите внимание на отсутствие синей области.
Кислород также не может образовывать водородные связи, опять же, потому что в молекулярной структуре нет доступных О-Н связей. Следовательно, мгновенные диполи и их молекулярная масса способствуют их силам рассеивания..
Несмотря на это, он хорошо растворяется в воде. Почему? Поскольку его атом кислорода, с более высокой электронной плотностью, может принимать водородные связи от молекулы воды:
Эти взаимодействия ответственны за растворение 6,04 г этого эфира в 100 мл воды..
Практическая работа № 6. Получение этилового эфира уксусной кислоты. ГДЗ Химия 10-11 класс Цветков.
Есть подсказки к этой лабе?
Составьте уравнение реакции образования сложного эфира из уксусной кислоты и этилового спирта.
Для работы воспользуйтесь прибором, изображенным на рисунке 64, несколько видоизменив его, как указано ниже.
Налейте в колбу 10-12 мл выданной вам смеси этилового спирта, уксусной кислоты и серной кислоты. Присоедините к колбе водяной или воздушный холодильник, нижний конец которого опустите в приемник, помещенный в смесь воды со льдом. Нагревайте смесь в колбе на водяной бане или через сетку (осторожно!). Когда соберется достаточное количество эфира и перегонка замедлится, опыт прекратите.
Чтобы освободить эфир от примеси спирта и кислоты, добавьте воды и смесь взболтайте. Затем разделите ее при помощи делительной воронки.
http://ru.thpanorama.com/articles/qumica/ter-etlico-propiedades-estructura-obtencin-usos.html
http://class.rambler.ru/temy-gdz/laboratornyy-opyt-6-poluchenie-etilovogo-efira-uksusnoy-kisloty-gdz-himiya-10-11-klass-cvetkov-28569.htm