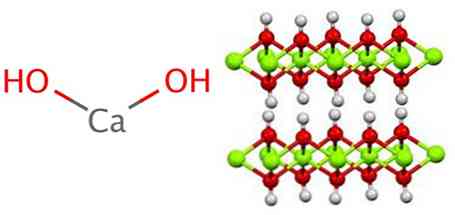
Гидроксид кальция: способы получения и химические свойства
Гидроксид кальция Ca(OH)2 — неорганическое соединение. Белый, при нагревании разлагается без плавления. Проявляет основные свойства.
Относительная молекулярная масса Mr = 74,09; относительная плотность для тв. и ж. состояния d = 2,08.
Способы получения
1. Гидроксид кальция получают в результате взаимодействия гидрида кальция и воды , на выходе образуется водород и гидроксид кальция :
2 . При взаимодействии кальция с водой при комнатной температуре образуется гидроксид кальция и водород:
3. Оксид кальция при взаимодействии с водой при комнатой температуре образует гидроксид кальция:
Качественная реакция
Качественная реакция на гидроксид кальция — окрашивание фенолфталеина в малиновый цвет .
Химические свойства
1. Гидроксид кальция вступает в реакцию с простыми веществами :
1.1. Холодный гидроксид кальция (суспензия) взаимодействует с хлором и образует гипохлорит кальция, хлорид кальция и воду:
если с хлором реагирует горячий гидроксид кальция (суспензия), то в итоге образуется хлорат кальция, хлорид кальция и вода:
2. Гидроксид кальция взаимодействует со сложными веществами :
2.1. Гидроксид кальция реагирует с кислотами:
2.1.1. В результате реакции между гидроксидом кальция и разбавленной соляной кислотой образуется хлорид кальция и вода:
2.1.2. Гидроксид кальция взаимодействует с серной кислотой, образуя сульфат кальция и воду:
2.1.3. В результате взаимодействия гидроксида кальция и разбавленной фосфорной кислоты образуется фосфат кальция и вода:
если с гидроксидом кальция будет взаимодействовать концентрированная фосфорная кислота , то в результате реакции образуется гидрофосфат кальция и вода:
2.1.4. С гидроксидом кальция реагирует сероводородная кислота , образуя гидросульфид кальция и воду:
2.2. Гидроксид кальция взаимодействует с оксидами:
2.2.1. В результате взаимодействия гидроксида кальция и углекислого газа образуется карбонат кальция и вода:
если с углекислым газом реагирует карбонат кальция в виде суспензии, то образуется гидрокарбонат кальция в растворе:
2.2.2. Гидроксид кальция вступает в реакцию с оксидом серы (IV) , образуя на выходе сульфит кальция и воду:
если с оксидом серы (IV) взаимодействует гидроксид кальция в виде суспензии, то на выходе происходит образование гидросульфита кальция в растворе:
2.4. Гидроксид кальция реагирует с солями :
2.4.1. Гидроксид кальция (суспензия) взаимодействует с холодным гипохлоритом натрия , образуя гипохлорит кальция и гидроксид натрия:
Ca(OH)2 + 2NaClO = Ca(ClO)2↓ + 2NaOH
2.5. Гидроксид кальция взаимодействует с пероксидом водорода при 40 — 50º С с образованием пероксида кальция и воды:
3. Гидроксид кальция разлагается при температуре 520 — 580º С, образуя на выходе оксид кальция и воду:
Формула гидроксида кальция, свойства, реакционная способность и применение
гидроксид кальция, также известный как гашеная известь или гашеная известь, является неорганическим соединением формулы Ca (OH)2.
Гидроксид кальция принимает полимерную структуру, как и все гидроксиды металлов, и идентичен гидроксиду магния (Mg (OH)).2) также известный как брусита.
Видно, что в этой структуре происходит образование водородных мостиков. Гидроксид кальция синтезируется в промышленности путем взаимодействия оксида кальция, также известного как известь или негашеная известь, с водой в соответствии со следующей реакцией:
Это также подготовлено в лаборатории реакцией между водным хлоридом кальция и гидроксидом натрия.
Гидроксид кальция встречается в природе, но редко в минеральной форме в виде портландита, который встречается в некоторых вулканических и метаморфических породах. (Формула гидроксида кальция — использование, свойства, структура и формула гидроксида кальция, 2005-2017).
Это соединение также широко доступно в цементе, растворителях и промышленных чистящих средствах (таких как строительные материалы), средствах для зачистки полов, чистящих средствах для кирпича, цементных загустителях и многих других..
Водный раствор обычно называют известковой водой. Известковая вода готовится путем перемешивания гидроксида кальция в чистой воде и фильтрации избытка Ca (OH)2 не растворяется.
Когда избыток гидроксида кальция добавляют в известковую воду, получают суспензию частиц гидроксида кальция, придавая ей молочный вид, и в этом случае он имеет общее название известкового молока. Известковое молоко или насыщенный известковый раствор (известковая вода) имеет рН 12,3, будучи основной природой..
Физико-химические свойства гидроксида кальция
Гидроксид кальция представляет собой белый или бесцветный порошок, лишенный запаха. В водном растворе (насыщенные растворы) он имеет молочный вид благодаря надосадочной жидкости из нерастворенного гидроксида кальция.
Ненасыщенные растворы, как правило, представляют собой прозрачные и бесцветные растворы с легким землистым запахом и горьким щелочным вкусом гидроксида кальция. Внешний вид соединения показан на рисунке 3 (Королевское химическое общество, 2015 г.)..
Гидроксид кальция имеет молекулярную массу 74,093 г / моль и плотность 2,211 г / см3 в твердом состоянии. Он имеет температуру плавления 580 градусов по Цельсию. Он плохо растворим в воде, способен растворять 1,89 г / л при 0 ° C, 1,73 г / л при 20 ° C и 0,66 г / л при 100 ° C..
Растворим в глицерине и в кислых растворах. Нерастворим в спирте (Национальный центр биотехнологической информации, С.Ф.).
Гидроксид кальция частично растворяется в воде, образуя раствор, называемый известковой водой, который является умеренным основанием. Известковая вода или Ca (OH)2 (вод) Он реагирует с кислотами с образованием солей и может воздействовать на некоторые металлы, такие как алюминий. Известковая вода легко реагирует с углекислым газом, образуя карбонат кальция, полезный процесс, называемый карбонизацией:
Нитропарафины, нитрометан, нитропропан и т. Д. Образуют соли с неорганическими основаниями, такими как гидроксид кальция. Эти сухие соли являются взрывоопасными. Соединение химически похоже на гидроксид натрия (NaOH) или оксид натрия (Na2О). Они нейтрализуют кислоты экзотермически с образованием солей и воды.
Смешивание этих материалов с водой может генерировать небезопасное количество тепла, поскольку основание растворяется или растворяется. Основания реагируют с некоторыми металлами (такими как алюминий и цинк) с образованием оксидов или гидроксидов металлов и образуют газообразный водород.
Основания могут инициировать реакции полимеризации в полимеризуемых органических соединениях, особенно эпоксидах. Легковоспламеняющиеся и / или токсичные газы могут образовываться из солей аммония, нитридов, галогенированных органических веществ, различных металлов, пероксидов и гидропероксидов. Этот тип соединения часто служит катализатором (Химический паспорт HYDROXIDE CALCIUM, S.F.).
Реактивность и опасности
Гидроксид кальция является стабильным соединением, хотя и несовместим с сильными кислотами. Он классифицируется как раздражающее соединение, и среди его опасностей можно выделить:
Это вызывает коррозию глаз (они вызывают повреждение роговицы или слепоту) и кожи (они вызывают воспаление и волдыри).
Вдыхание пыли вызовет раздражение желудочно-кишечного тракта или дыхательных путей, для которого характерны жжение, чихание и кашель. Сильное передержка может вызвать повреждение легких, асфиксию, потерю сознания или смерть. Воспаление глаз характеризуется покраснением, раздражением и зудом (паспорт безопасности материала Гидроксид кальция, 2013).
Повторное воздействие на глаза при низком уровне пыли может вызвать раздражение и локальное разрушение кожи или дерматит на коже. Повторное вдыхание пыли может вызывать различную степень раздражения дыхательных путей или повреждения легких.
Если это химическое вещество попало в глаза, их следует немедленно промыть большим количеством воды, иногда поднимая нижнее и верхнее веко. Необходимо немедленно обратиться к врачу. Контактные линзы не должны использоваться при работе с этим химическим веществом.
Если этот химикат вступает в контакт с кожей, кожу, загрязненную мылом и водой, следует немедленно промыть. Если этот химикат проникнет в одежду, немедленно снимите одежду и промойте кожу водой. Если раздражение не проходит после стирки, обратитесь к врачу.
При вдыхании большого количества этого химического вещества человека, подвергшегося воздействию, следует немедленно вывести на свежий воздух. Если дыхание прекратилось, выполните реанимацию изо рта в рот, также поддерживая пострадавшего в тепле и покое. Получить медицинскую помощь как можно скорее.
При проглатывании немедленно обратитесь к врачу и, если возможно, покажите контейнер или этикетку (отравление гидроксидом кальция, 2017 г.).
Обработка и хранение
- Состав должен храниться в сухом контейнере.
- Не глотать и не вдыхать пыль.
- Вода никогда не должна добавляться к этому продукту.
- В случае отсутствия вентиляции возьмите с собой соответствующее дыхательное оборудование..
- Избегать контакта с кожей и глазами.
- Хранить вдали от несовместимых как кислоты.
- Держите контейнер плотно закрытым.
- Храните контейнер в прохладном и хорошо проветриваемом месте. Не хранить выше 25 градусов по Цельсию.
Использование и приложения
Гидроксид кальция производится в больших масштабах, с ним легко обращаться, и он, как правило, дешев, поэтому существует много заметных областей применения и применений..
Значительное применение гидроокиси кальция подобно флокулянту при очистке воды и сточных вод. Он образует пушистое заряженное твердое вещество, которое помогает в удалении мелких частиц из воды, в результате чего получается более легкий продукт..
Это приложение обеспечивается низкой стоимостью и низкой токсичностью гидроксида кальция. Это также используется в обработке пресной воды, чтобы поднять pH воды. Цель состоит в том, чтобы трубы не подвергались коррозии там, где базовая вода является кислой.
Другое большое применение в бумажной промышленности, где он используется в производстве гидроксида натрия. Это преобразование является компонентом известного крафт-процесса, который используется при экстракции пульпы..
В системах жизнеобеспечения, таких как скруббер с углекислым газом, особенно в закрытых циркуляционных респираторах, где гидроксид лития, будучи более едким, считается слишком рискованным.
Он используется в качестве ингредиента при отбеливании и штукатурке с так называемыми известковыми растворами. В дорожном строительстве гидроксид кальция служит для улучшения качества почвы.
Согласно Национальным институтам здравоохранения, гидроксид кальция обычно используется в стоматологии в качестве антимикробного средства и является предпочтительным веществом для формирования защитного слоя, известного как апикальный барьер..
Апикальные барьеры обычно используются в качестве средства, позволяющего избежать некроза пульпы в ситуациях, когда эндодонтическая хирургия будет особенно трудной, что обычно является результатом незрелого постоянного зуба..
Поскольку гидроксид кальция может помочь дезинфицировать зуб там, где инфекция уже существует, его можно использовать в качестве краткосрочного лечения для уменьшения боли и воспаления при подготовке к эндодонтической хирургии (Gottfried Schmalz, 2009).
Он служит добавкой для морской воды, потому что он снижает содержание CO2 в атмосфере и смягчает парниковый эффект.
При производстве металлов известь впрыскивается в поток отходящих газов для нейтрализации кислот, таких как фториды и хлориды, перед выбросом в атмосферу..
Гидроксид кальция используется в качестве активного щелочного ингредиента в некоторых продуктах для релаксации волос.
По данным Корнелльского центра исследований материалов, гидроксид кальция может выпрямлять вьющиеся волосы, потому что он разрывает дисульфидные связи, которые связывают цистеины, аминокислоты, которые присутствуют в более высоких концентрациях в естественных вьющихся волосах. Разрушение этих связей и герметизация их гидроксидом кальция навсегда изменяет физическую структуру обработанных волос..
В бордоской смеси гидроксид кальция служит для нейтрализации раствора и образования пролонгированного фунгицида.
Он используется в нефтеперерабатывающей промышленности для производства присадок к маслам (салицилаты, сульфиды, фенолы), в нефтехимической промышленности для производства твердых масел различных марок, а также в химической промышленности для производства стеарата кальция. , Обычно используется для изучения углекислого газа и поглощения газа.
Гидроксид кальция используется при изготовлении тормозных колодок, при приготовлении сухих смесей для окраски и отделки, а также при изготовлении смесей для пестицидов..
Он также используется в качестве добавки кальция и рН / карбонатного буфера для аквакультуры кораллов в рифовых аквариумах..
Это «альтернатива» естественный инсектицид, большинство ползающих насекомых умирают от контакта с ним, включая клещей, блох, жуков и личинок (Russiver, 2015).
Гидроксид кальция является эффективным решением для отделения волос от кожи животных, при его подготовке к производству кожи.
Смесь гидроокиси кальция и теплой воды создает ванну, в которой свежая кожа должна выдерживаться до четырех дней и часто встряхиваться. Этот процесс ослабляет волосы и кожу до такой степени, что обычно ее можно удалить вручную.
Из-за своей низкой токсичности и мягкости основных свойств гашеная известь широко используется в пищевой промышленности для:
- Для очистки сырого сока сахарного тростника или сахарной свеклы в сахарной промышленности, технологической воды для алкогольных и безалкогольных напитков, солений и других продуктов питания.
- Кукурузные лепешки (мука помогает собирать кукурузу). Кукуруза, приготовленные с известью становится мамалыгу, что значительно увеличивает биодоступность ниацина, также считается вкуснее и легче усваивается.
- Очистить рассол от карбонатов кальция и магния при производстве соли для пищевых и фармацевтических целей.
- Фортифицируйте фруктовые напитки, такие как апельсиновый сок и детское питание (BAUM, 2013).
Гидроксид кальция
| Гидроксид кальция | |
|---|---|
| Систематическое наименование | Гидроксид кальция |
| Традиционные названия | гашёная (едкая) известь |
| Хим. формула | Ca(OH)2 |
| Рац. формула | Ca(OH)2 |
| Состояние | белые кристаллы |
| Молярная масса | 74.093 г/моль |
| Плотность | 2.211 г/см³ |
| Температура | |
| • плавления | 512 °C |
| • разложения | 580 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость | |
| • в воде | 0.185 г/100 мл |
| ГОСТ | ГОСТ 9262-77 |
| Рег. номер CAS | [1305-62-0] |
| PubChem | 6093208 |
| Рег. номер EINECS | 215-137-3 |
| SMILES | |
| Кодекс Алиментариус | E526 |
| RTECS | EW2800000 |
| ChEBI | 31341 |
| ChemSpider | 14094 и 21170965 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидроксид кальция (гашёная известь, едкая) — химическое вещество с формулой Ca(OH)2, сильное основание. Представляет собой мелкокристаллический порошок белого цвета, малорастворимый в воде.
Содержание
- 1 Некоторые распространённые названия
- 2 Получение
- 3 Физические свойства
- 4 Химические свойства
- 5 Применение
Некоторые распространённые названия
- Гашёная известь — так как её получают путём «гашения» (то есть взаимодействия с водой) «негашеной» извести (оксида кальция).
- Известковое молоко — взвесь (суспензия), образуемая при смешивании избытка гашёной извести с водой. Внешне похожа на молоко.
- Известковая вода — прозрачный бесцветный раствор гидроксида кальция, получаемый при фильтровании или отстаивании известкового молока.
- Известь-пушонка — при гашении негашёной извести ограниченным количеством воды образуется белый рассыпающийся мелкокристаллический пылевидный порошок.
Получение
Получают путём взаимодействия оксида кальция (негашёной извести) с водой (процесс получил название «гашение извести»):
Эта реакция сильно экзотермическая, происходит с выделением 16 ккал на моль (67 кДж на моль).
Физические свойства
| Температура, °C | Растворимость, г Ca(OH)2/100 г H2O |
|---|---|
| 0 | 0,173 |
| 20 | 0,166 |
| 50 | 0,13 |
| 100 | 0,08 |
По внешнему виду представляет собой белый порошок, малорастворимый в воде. Растворимость в воде падает с ростом температуры.
При нагреве вещества до температуры 512 °C парциальное давление водяного пара, находящегося в равновесии с гидроксидом кальция становится равным атмосферному давлению (101,325 кПа) и гидроксид кальция начинает терять воду, превращаясь в оксид кальция, при температуре 600 °C процесс потери воды практически полностью завершается:
Кристаллизуется в гексагональной кристаллической структуре.
Химические свойства
Гидроксид кальция является довольно сильным основанием, из-за чего водный раствор имеет сильнощелочную реакцию.
Как и все основания, реагирует с кислотами; как щелочь участвует в реакциях нейтрализации кислот (см. реакция нейтрализации) с образованием соответствующих солей кальция, например:
Реакцией нейтрализации обусловлено постепенное помутнение раствора гидроксида кальция при стоянии на воздухе, так как гидроксид кальция, взаимодействует с поглощённым из воздуха углекислым газом, как и растворы других сильных оснований, эта же реакция происходит при пропускании углекислого газа через известковую воду, — реакции качественного анализа на углекислый газ:
При дальнейшем пропускании углекислого газа через известковую воду раствор снова становится прозрачным, так как при этом образуется кислая соль — гидрокарбонат кальция, имеющий более высокую растворимость в воде, причём при нагревании раствора гидрокарбоната кальция он снова разлагается с выделением углекислого газа и при этом выпадает осадок карбоната кальция:
Гидроксид кальция реагирует с оксидом углерода при температуре около 400 °C:
Реагирует с некоторыми солями, но реакция происходит только в том случае, если в результате реакции одно из образующихся веществ плохо растворимое и выпадает в осадок, например:
Ca(OH)2 + Na2SO3 → CaSO3↓ + 2NaOH .
http://ru.thpanorama.com/articles/qumica/hidrxido-de-calcio-frmula-propiedades-reactividad-y-usos.html
http://chem.ru/gidroksid-kalcija.html