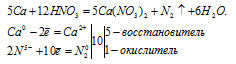Окислительно-восстановительные свойства металлов. Ряд напряжения металлов
Вопрос 1.
Уравнение реакции образования железной окалины имеет вид:
Fe3O4 — представляет собой смесь двух оксидов FeO и Fe2O3. Поэтому уравнение реакции (І) можно условно представить в виде двух уравнений и для каждого составить уравнение электронного баланса.
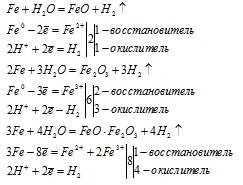
Таким образом, в реакции образования железной окалины три атома железа отдают не 6 и не 9, а 8 электронов.
Вопрос 2.
Вопрос 3.
Вопрос 4.
Щелочные и щелочноземельные металлы очень активны и реагируют практически со всем, с чем соприкасаются. Например, на воздухе эти металлы легко окисляются и, при этом разрушаются. Их хранят под слоем керосина, к которому они инертны, этим они сберегаются от ненужных взаимодействий. Литий — самый легкий из металлов. Он легче керосина и в отличие от других металлов всплывает в нем, поэтому его хранят в вазелине.
Вопрос 5.
Вопрос 6.
По правилу, которое гласит, что металлы, стоящие в ряду напряжения левее водорода, вытесняют его из растворов кислот, водород при реакции свинца с раствором серной кислоты должен получиться. Но данное правило соблюдается, если в реакции металла с кислотой образуется растворимая соль, а так как PbSO4 — нерастворимая соль то правило не соблюдается, и водород нельзя получить при взаимодействии свинца с раствором серной кислоты.
Вопрос 7. 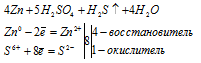
В данной реакции цинк проявляет восстановительные свойства, а сера – окислительные.
Оксид железа (II, III)
Оксид железа (II, III)
Оксид железа (II, III) (железная окалина, магнетит) – это твердое, нерастворимое в воде вещество черного цвета.
Фото с сайта wikipedia.ru
Способы получения
Оксид железа (II, III) можно получить различными методами :
1. Горение железа на воздухе:
2. Частичное восстановление оксида железа (III) водородом или угарным газом :
3. При высокой температуре раскаленное железо реагирует с водой, образуя двойной оксид железа (II, III):
Химические свойства
Свойства оксида железа (II, III) определяются свойствами двух оксидов, из которых он состоит: основного оксида железа (II) и амфотерного оксида железа (III).
1. При взаимодействии оксида железа (II, III) с кислотными оксидами и кислотами образуются соли железа (II) и железа (III).
Например , оксид железа (II, III) взаимодействует с соляной кислотой. При это образуются две соли – хлорид железа (II) и хлорид железа (III):
Еще пример : оксид железа (II, III) взаимодействует с разбавленной серной кислотой.
2. Оксид железа (II, III) взаимодействует с сильными кислотами-окислителями (серной-концентрированной и азотной).
Например , железная окалина окисляется концентрированной азотной кислотой:
Разбавленной азотной кислотой окалина окисляется при нагревании:
Также оксид железа (II, III) окисляется концентрированной серной кислотой:
Также окалина окисляется кислородом воздуха :
3. Оксид железа (II, III) не взаимодействует с водой.
4. Оксид железа (II, III) окисляется сильными окислителями до соединений железа (VI), как и прочие оксиды железа (см. выше).
5. Железная окалина проявляет окислительные свойства .
Например , оксид железа (II, III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II):
Также железная окалина восстанавливается водородом:
Оксид железа (II, III) реагирует с более активными металлами .
Например , с алюминием (алюмотермия):
Оксид железа (II, III) реагирует также с некоторыми другими сильными восстановителями (йодидами и сульфидами).
Например , с йодоводородом:
1 Определите число электронов, которое отдают три атома железа молекуле воды в реакции образования железной окалины.
Запишем уравнение реакций образования железной окалины.
То есть получили, что в реакции образования железной окалины три атома железа отдают 8 электронов.

задача №1
к главе «Глава 1. Металлы. § 8(8). Химические свойства металлов».
http://chemege.ru/%D0%BE%D0%BA%D1%81%D0%B8%D0%B4-%D0%B6%D0%B5%D0%BB%D0%B5%D0%B7%D0%B0-ii-iii/
http://5terka.com/node/10423