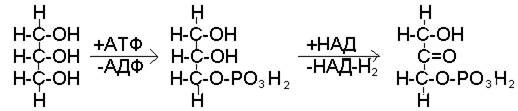Расчетные задачи в органической химии
Окисление глицерина перманганатом калия
Задача 48.
Напишите три уравнения реакций окисления многоатомных спиртов на примере глицерина перманганатом калия.
Решение:
1. Окисление глицерина перманганатом калия
Процесс окисления многоатомных спиртов происходит ступенчато. При жестком окислении глицерина перманганатом в присутствии ионов Н+ (концентрированная серная кислота при нагревании) возможно окисление первичных спиртовых групп до карбоксильных (-СООН), а вторичных — до кетонных (=О):
Реакция протекает через несколько стадий и при этом образуется конечное вещество: СООНС(О)СООН — 2-оксопропандиовая кислота (диоксипропандиовая кислота)) или 2-оксомалоновая кислота (диоксималоновая кислота) , а также
2-оксометандикарбоновая кислота.
Водный раствор диоксипропандиовой кислоты называется мезоксалевой кислотой:
2. Реакция Карла Шееле
При смешивании глицерина с кристаллическим перманганатом калия (марганцовкой) происодит бурная реакция ( яркая вспышка смеси). Взаимодействие сопровождается выделением большого количества теплоты и газов (углекислый газ СО2 и пары воды Н2О), которые увлекают за собой горячие твердые частицы диоксида марганца МnО2 и карбоната калия К2CO3:
3. Глицерин при взаимодействии с перманганатом калия КMnО4 в присутствии H2SO4 возможно окисление по реакции:
Получение 1,2-дийодперфторбутана
Задача 49.
Рассчитайте загрузку иода на первую стадию процесса, при условии, что расчет надо вести на C4F8J2. Заполнение реактора 80% при максимальной температуре процесса 230°С. Реактор V = 2л.
Решение:
I2 ⇔ 2I•
CF2=CF2 + I• ⇔ CF2I– CF2•
CF2I– CF2• + I• ⇔ CF2I– CF2I
Процесс начинается с термодиссоциации иода с образованием атомарного иода, который вступает в реакцию с тетрафторэтилена (ТФЭ) с образованием тетрафторэтилиодидного радикала, который стабилизируется за счет присоединения атома иода с образованием 1,2-дииодперфторэтана (ДИЭ).
Процесс образования 1,2-дийодперфторбутана из дийодперфторэтана и тетрафторэтилена (ТФЭ) может быть описан следующими уравнениями:
Из уравнений реакций вытекает, что на образование 1 моль C4F8J2 затрачивается 1 моль I2, т.е n(I2) = n(C4F8J2).
n(C4F8J2) = V(C4F8J2)/Vm = [V(сосуда) . 0,8]/Vm = (2 . O,8)/22,4 = 0,0714 моль.
m(I2) = n(I2) . M(I2) = 0,0714 . 253,8089 = 18,12 г.
Нахождение состава смеси метана и этана
Задача 50.
При сжигании 20 л смеси метана и этана добыто 25 л карбон (IV) оксида. Найти состав смеси в обьемных частях.
Решение:
Уравнения реакции горения веществ будут иметь вид:
1) CH4 + O2 = CO2 + 2H2O
2) C2H6 + 3,5O2 = 2CO2 + 3H2O
Из уравнений горения газов вытекает, что при сгорании 1 моль метана образуется 1 моль углекислого газа, а при сгорании этана — 2 моль.
Примем объм метана и этана в газовой смеси за «х» и «у» соответственно, а объёмы СО2 — Х и 2Y.
Для вычисления состава смеси метана и этана в обьемных частях составим уравнение с двуья паременными, плоучим:
Решим систему линейных уравнений методом подстановки:
Выразим из первого уравнения х + у = 20 данной системы «y» через «x«, получим:
Подставив во второе уравнение х + 2у = 25 данной системы вместо «y» выражение (20 — х), получим систему:
Полученные системы равносильны. В последней системе второе уравнение содержит только одну переменную. Решим это уравнение, получим:
Тогда «у» = 20 — «х» = 20 — 15 = 5.
Окисление глицерина
На первом этапе этих превращений затрачивается энергия: глицерин вступает в реакцию с АТФ с образованием глицерофосфата и АДФ. На следующем этапе превращений происходит окисление фосфоглицерина и его превращение в фосфодиоксиацетон (рис. 42).
глицерин фосфоглицерин фосфодиоксиацетон
Рис. 42. Начальные этапы использования глицерина в качестве источника энергии
Перенос водорода с НАД-Н2, образующегося в ходе этой реакции, на кислород по цепи дыхательных ферментов сопряжен с ресинтезом трех молекул АТФ. Таким образом, не только компенсируются первоначальные затраты энергии, но и образуется две дополнительных молекулы АТФ.
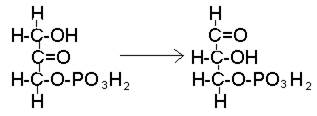
Фосфодиоксиацетон преобразуется в свой изомер – фосфоглицериновый альдегид, дальнейшие превращения которого тождественны превращениям, происходящим в процессе окисления углеводов (рис. 43).
Рис. 43. Превращение фосфодиоксиацетона в фосфоглицериновый альдегид
Через несколько этапов он превращается в пировиноградную кислоту (ПВК), затем в ацетил-КоА, превращения которого завершаются в цикле трикарбоновых кислот (ЦТКК). Конечными продуктами окисления глицерина являются Н2О и СО2.
Глицерин является достаточно энергоемким веществом. При полном (до СО2и Н2О) окислении одной молекулы глицерина освобождается энергия, за счет которой может быть ресинтезирована 22 молекулы АТФ (с учетом затрат одной молекулы АТФ на начальном этапе превращений).
Дата добавления: 2015-10-29 ; просмотров: 13251 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://helpiks.org/5-93140.html http://acetyl.ru/o/a31j2i3i.php |