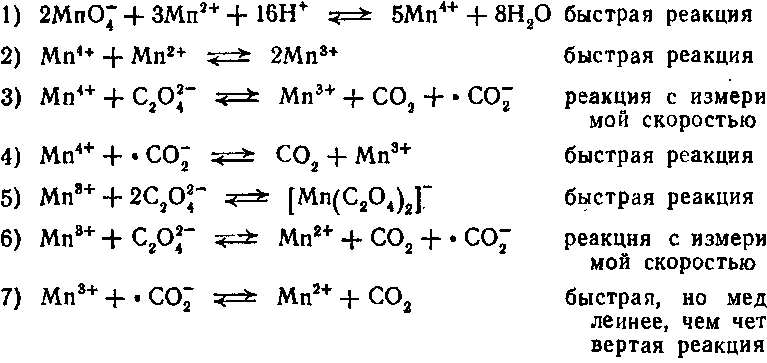Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Автокаталитическое окисление щавелевой кислоты перманганатом калияИндуцированная реакция окисления оксалатов перманганатом калия довольно сложна. Механизм реакции пока еще полностью не выяснен. Реакция, по всей вероятности, является сопряженной, причем марганец(II) выполняет роль индуктора (поэтому реакцию относят к типу автокаталитических). В отсутствие марганца(II) реакция характеризуется длительным индукционным периодом, в течение которого происходит накопление ионов марганца в различной степени окисления. В присутствии марганца (II) реакция протекает практически мгновенно. По-видимому, наиболее вероятна следующая схема процесса [12]: Марганец(III), кроме указанного комплекса с окса-лат-ионом, образует также комплексы состава Щавелевая кислота, насыщенный раствор. Перманганат калия, 0,01 н. раствор. Сульфат марганца, 20%-иый раствор. Выполнение опыта. В цилиндр поместить 200 мл раствора перманганата калия и 200 мл воды. На лекции разделить раствор на две части. К первой части добавить раствор щавелевой кислоты. Цвет не меняется. Ко второй части добавить столько же щавелевой кислоты и 50 мл раствора сульфата марганца. Раствор буреет, затем желтеет и, наконец, полностью обесцвечивается. Отметить, что приблизительно через 1 ч раствор и в первом цилиндре также обесцвечивается. Примечание. Для успеха лекционного опыта рекомендуется в раствор сульфата марганца добавить равный объем 18 н. раствора серной кислоты. Определение нормальности перманганата калия по щавелевой кислотеРеакция между перманганатом калия и щавелевой кислотой протекает по уравнению: Реакция автокаталитическая, катализатором являются ионы Mn 2+ , поэтому для ускорения реакции смесь необходимо подогреть до температуры 80-90ºС. Бюретку заполняют рабочим раствором KMnO4, предварительно ополоснув ее дистиллированной водой и рабочим раствором KMnO4. Уровень жидкости в бюретке устанавливают на нуле по верхнему краю мениска, ввиду темной окраски раствора Мерную пипетку вместимостью 10 мл промыть дистиллированной водой и ополоснуть раствором щавелевой кислоты. В колбу для титрования отмеряют пипеткой 10 мл раствора щавелевой кислоты, добавляют цилиндром 7-10 мл 2н раствора H2SO4 и подогревают до 80-90º С на асбестовой сетке над газовой горелкой или на электрической плитке с закрытой спиралью. Доводить до кипения раствор в колбе нельзя. Горячий раствор H2C2O4 титруют раствором перманганата калия при постоянном перемешивании, добавляют очередную каплю KMnO4 после обесцвечивания раствора. Скорость реакции постепенно увеличивается. Титрование заканчивают в тот момент, когда бледно-розовая окраска раствора в колбе, появляется от одной избыточной капли раствора KMnO4 и не исчезает в течение 1-2 минут. Титруют до получения не менее трех сходящихся результатов. Запись результатов титрования и вычисление нормальности и титра перманганата калия по железу выполняют в следующей последовательности: г-экв(Fe 2+ ) =1 · 55,85 =55,85 г T (KMnO4/ Fe 2+ ) = N(KMnO4)·55,85 / 1000 [г/мл] Контрольная задача Определение количества железа (II) в растворе соли Мора Реакция между солью двухвалентного железа и перманганатом калия в кислой среде протекает по уравнению: В мерную колбу вместимостью 100 мл получают у преподавателя или инженера-химика контрольный раствор соли Мора. Доводят до метки дистиллированной водой, и плотно закрыв колбу пробкой, тщательно перемешивают. Устанавливают бюретку, вставляют в неё воронку и промывают сначала дистиллированной водой, затем ополаскивают рабочим раствором КMnO4. Бюретку наполняют рабочим раствором перманганата калия, предварительно заполнив носик. Уровень жидкости на нуле устанавливают по верхнему краю мениска. Пипетку емкостью 10 мл промывают дистиллированной водой, ополаскивают раствором соли Мора. В колбу для титрования отмеряют пипеткой 10 мл раствора соли Мора, добавляют цилиндром 5 – 7 мл 2 н раствора H2SO4 и титруют раствором КMnO4 до появления не исчезающей в течение 1-2 минут бледно-розовой окраски, появившейся от одной избыточной капли раствора КMnO4. Титрование проводят до получения не менее трех сходящихся результатов. Запись результатов титрования и вычисления проводят в следующей последовательности: Q(Fe) = VСР(KMnO4) · T (KMnO4/ Fe 2+ )·Vколбы / Vпипетки [г]. Определив практическую массу железа в контрольном растворе соли Мора, возьмите у инженера-химика теоретическое значение и вычислите погрешности. Примеры решения типовых задач Задача 4. Вычислить нормальность и титр перманганата калия (KMnO4) по железу, зная, что на титрование раствора щавелевой кислоты, содержащего 0,01399 г Н2С2О4 · 2Н2О, израсходовано 12,44 см 3 раствора перманганата калия. Решение. 1) Задача на метод окислительно-восстановительного титрования – перманганатометрия. 2 │MnO4 − + 8H + +5ē → Mn 2+ + 4H2O 2) Метод прямого титрования g / г-экв = N·V /1000; N = g · 1000 / г-экв · V; г-экв (Fe) = 55,85 г. 3) N(KMnO4) = 0,01399 ∙ 1000 / 63,03 ∙ 12,44 = 0,01784 н. T( KMnO4/Fe) = 0,01784 ∙ 55,85 / 1000 = 0,0009962 г/с Задача 5. Вычислить количество меди, содержащееся в 250 см 3 раствора медного купороса, если на титрование 25,00 см 3 этого раствора израсходовано 27,75 см 3 0,01848 н раствора тиосульфата натрия. Решение. 1) Задача на метод окисления-восстановления – йодометрия. 2) Титрование по методу замещения N(CuSO4) = 0,01848 · 27,75 / 25,00 = 0,02051н. g(Cu) = 0,02051 · 250 · 63,55 / 1000 = 0,3259 г МЕТОДЫ КОМПЛЕКСООБРАЗОВАНИЯ В основе методов лежат реакции образования комплексных соединений, в результате которых определяемый ион количественно выводится из раствора. источники: http://www.himikatus.ru/art/demo-exp/0175.php http://allrefrs.ru/3-15249.html |