Оксид меди (II)
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами :
1. Термическим разложением гидроксида меди (II) при 200°С :
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 → 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства) . При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например , оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например , оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например , оксид меди (II) окисляет аммиак :
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Более активные металлы вытесняют медь из оксида.
Например , алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Оксид меди 2, химическая формула и свойства
Оксиды — широко распространённый в природе тип соединений, который можно наблюдать даже в повседневной жизни, в быту. Примером могут служить песок, вода, ржавчина, известь, углекислый газ, ряд природных красителей. Руда многих ценных металлов по своей природе является оксидом, вследствие чего представляет большой интерес для научных и производственных исследований.
Соединение химических элементов с кислородом называют оксидами. Как правило, образуются они при накаливании каких-либо веществ на воздухе. Различают кислотные и основные оксиды. Металлы образуют основные оксиды, в то время как неметаллы — кислотные. За исключением оксидов хрома и марганца, которые также являются кислотными. В данной статье рассматривается представитель основных оксидов — CuO (II).
CuO (II)
Медь, нагреваясь на воздухе при температуре 400–500 °C, постепенно покрывается налётом чёрного цвета, который химики называют оксид двухвалентной меди, или CuO(II). Описанное явление представлено в следующем уравнении:
2 Cu + О 2 → 2 CuO
Термин «двухвалентный» указывает на способность атома вступать в реакцию взаимодействия с другими элементами посредством двух химических связей.
Интересный факт! Медь, находясь в различных соединениях, может быть с разной валентностью и другим цветом. Например: оксиды меди имеют ярко-красную (Cu2O) и коричнево-чёрную (CuO) окраску. А гидроксиды меди приобретают жёлтый (CuOH) и синий (Cu(OH)2) цвета. Классический пример явления, когда количество переходит в качество.
Cu2O ещё иногда называют закись, оксид меди (I), а CuO — окись, оксид меди (II). Существует также оксид меди (III) — Cu2O3.
В геологии оксид двухвалентной (или бивалентной) меди принято называть тенорит, другое его название — мелаконит. Название тенорит произошло от фамилии выдающегося итальянского профессора ботаники Michele Tenore, (1780—1861). Мелаконит считается синонимом названия тенорит и переводится на русский язык, как медная чернь либо чёрная медная руда. В том или ином случае речь идёт о кристаллическом минерале коричнево-чёрного цвета, разлагающемся при прокаливании и плавящемся только при избыточном давлении кислорода, в воде нерастворимом, и не реагирующем с ней.
Акцентируем основные параметры названного минерала.
Химическая формула: CuO
Молекула его состоит из атома Cu с молекулярной массой 64 а. е. м. и атома O, молекулярная масса 16 а. е. м., где а. е. м. — атомная единица массы, она же дальтон, 1 а. е. м. = 1,660 540 2(10) × 10 −27 кг = 1,660 540 2(10) × 10 –24 г. Соответственно молекулярная масса соединения равняется: 64 + 16 = 80 а. е. м.
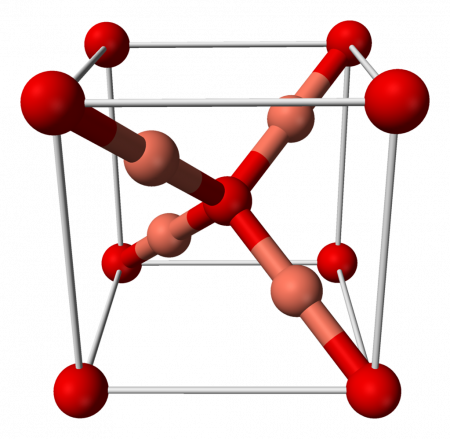
Кристаллическая решётка: моноклинная сингония. Что обозначает такой тип осей симметрии кристалла, когда две оси пересекаются под косым углом и имеют различную длину, а третья ось расположена по отношению к ним под углом 90°.
Плотность – 6,51 г/см 3 . Для сопоставления, плотность чистого золота равна 19,32 г/см³, а плотность поваренной соли составляет 2,16 г /см 3 .
Плавится при температуре 1447 °C, под давлением кислорода.
Разлагается при накаливании до 1100 °C и преобразуется в оксид меди (I):
4CuO = 2Cu2O + O 2.
С водой не реагирует и не растворяется в ней.
Зато вступает в реакцию с водным раствором аммиака, с образованием гидроксида тетраамминмеди (II): CuO + 4NH3 + H2O = [Cu (NH3)4](OH) 2.
В кислотной среде образует сульфат и воду: CuO + H2SO4 = CuSO4 + H2O.
Реагируя со щёлочью, создаёт купрат: CuO + 2 NaOH → Na2CuO2 + H2O.
Реакция CuO NaOH
Образуется:
- путём прокаливания гидроксида меди (II) при температуре 200 °C: Cu(OH)2 = CuO + H2O;
- при окислении металлической меди на воздухе при температуре 400–500 °C: 2Cu + O2 = 2CuO;
- при высокотемпературной обработке малахита: (CuOH)₂CO₃ —> 2CuO + CO₂ + H₂O.
Восстанавливается до металлической меди —
- в реакции с водородом: CuO + H2 = Cu + H2O;
- с угарным газом (монооксид углерода): CuO + CO = Cu + CO2;
- с активным металлом: CuO + Mg = Cu + MgO.
Токсичен. По степени неблагоприятного воздействия на человеческий организм причисляется к веществам второго класса опасности. Вызывает раздражение слизистых оболочек глаз, кожных покровов, дыхательных путей и желудочно-кишечной системы. При взаимодействии с ним обязательно использование таких средств защиты, как резиновые перчатки, респираторы, защитные очки, спецодежду.
Вещество взрывоопасно и легко воспламеняется.
Применяется в промышленности, как минеральная составляющая комбикормов, в пиротехнике, при получении катализаторов химических реакций, как красящий пигмент для стекла, эмалей, керамики.
Окислительные свойства оксида меди (II) наиболее часто применяются в лабораторных исследованиях, когда необходим элементарный анализ, связанный с изучением органических материалов на предмет наличия в них водорода и углерода.
Немаловажно, что CuO (II) достаточно широко распространён в природе, как минерал тенерит, другими словами — это природное соединение руды, из которого можно получить медь.
Латинское наименование Cuprum и соответствующий ему символ Cu происходит от названия острова Кипр. Именно оттуда, через Средиземное море вывозили этот ценный металл древние римляне и греки.
Медь входит в число семи наиболее распространённых в мире металлов и состоит на службе у человека с древних времён. Однако в первозданном, металлическом состоянии встречается довольно редко. Это мягкий, легко поддающийся обработке металл, отличающийся высокой плотностью, очень качественный проводник тока и тепла. По электрической проводимости уступает только серебру, в то время как является более дешёвым материалом. Широко используется в виде проволоки и тонкого листового проката.
Химические соединения меди отличаются повышенной биологической активностью. В животных и растительных организмах они участвуют в процессах синтеза хлорофилла, поэтому считаются очень ценным компонентом в составе минеральных удобрений.
Необходима медь и в рационе человека. Недостаток её в организме может привести к различным заболеваниям крови.
Видео
Из видео вы узнаете, что такое оксид меди.
Оксид меди (I)
| Оксид меди (I) | |
|---|---|
 | |
| Традиционные названия | Закись меди, гемиоксид меди, оксид димеди |
| Хим. формула | Cu2O |
| Рац. формула | Cu2O |
| Внешний вид | Коричнево-красные кристаллы |
| Молярная масса | 143,09 г/моль |
| Плотность | 6,1 г/см³ |
| Твёрдость | 3,5 — 4 |
| Энтальпия | |
| • плавления | +64,22 кДж/моль |
| Растворимость | |
| • в воде | 2,4⋅10 −7 г/100 мл |
| Показатель преломления | 2,85 |
| Кристаллическая структура | кубическая |
| Рег. номер CAS | 1317-39-1 |
| PubChem | 10313194 |
| Рег. номер EINECS | 215-270-7 |
| SMILES | |
| RTECS | GL8050000 |
| ChEBI | 81908 |
| ChemSpider | 8488659 |
| ЛД50 | 470 мг/кг |
| Токсичность | средняя |
| Пиктограммы СГС |   |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид меди (I) (гемиоксид меди, окси́д димеди, устар. закись меди) — химическое соединение с формулой Cu2O . Соединение меди с кислородом, основный оксид. Кристаллическое вещество коричнево-красного цвета. В природе встречается в виде минерала куприта.
Содержание
- 1 Нахождение в природе
- 2 Физические свойства
- 3 Химические свойства
- 3.1 Реакции в водных растворах
- 3.2 Реакции при высоких температурах
- 3.3 Прочие реакции
- 4 Получение
- 5 Применение
- 6 Токсичность
Нахождение в природе
Оксид меди (I) встречается в природе в виде минерала куприта (устаревшие названия: красная медная руда, стекловатая медная руда, рубиновая медь). Цвет минерала красный, коричнево-красный, пурпурно-красный или чёрный. Твёрдость по шкале Мооса 3,5 — 4.
Разновидность куприта с удлиненными нитевидными кристаллами называется халькотрихит (устаревшее название: плюшевая медная руда). Кирпично-красная смесь куприта с лимонитом носит название «черепичная руда».
Физические свойства
Оксид меди (I) при нормальных условиях — твёрдое вещество коричнево-красного цвета нерастворимое в воде и этаноле. Плавится без разложения при 1242 °C.
Оксид меди (I) имеет кубическую сингонию кристаллической решётки, пространственная группа P n3m, a = 0,4270 нм, Z = 2.
Химические свойства
Реакции в водных растворах
Оксид меди (I) не реагирует с водой. В очень малой степени (ПР = 1,2⋅10 −15 ) диссоциирует:
Оксид меди (I) переводится в раствор:
- концентрированной соляной кислотой
Cu2O + 4HCl ⟶ 2H[CuCl2] + H2O
- концентрированной щёлочью (частично)
Cu2O + 2OH − + H2O ⇄ 2[Cu(OH)2] −
- концентрированным гидратом аммиака и концентрированными растворами солей аммония
Cu2O + 4(NH3 ⋅ H2O) ⟶ 2[Cu(NH3)2]OH + 3H2O Cu2O + 2NH4 + ⟶ 2[Cu(H2O)(NH3)] +
- путём окисления до солей меди (II) различными окислителями (например, концентрированными азотной и серной кислотами, кислородом в разбавленной соляной кислоте)
Cu2O + 6HNO3 ⟶ 2Cu(NO3)2 + 2NO2↑ + 3H2O Cu2O + 3H2SO4 ⟶ 2CuSO4 + SO2↑ + 3H2O 2 Cu2O + 8HCl + O2 ⟶ 4CuCl2 + 4H2O
Также оксид меди (I) вступает в водных растворах в следующие реакции:
- медленно окисляется кислородом до гидроксида меди (II)
2 Cu2O + 4H2O + O2 ⟶ 4Cu(OH)2↓
- реагирует с разбавленными галогенводородными кислотами с образованием соответствующих галогенидов меди (I):
Cu2O + 2HHal ⟶ 2CuHal↓ + H2O (Hal = Cl, Br, I)
- в разбавленной серной кислоте дисмутирует на сульфат меди (II) и металлическую медь
Cu2O + H2SO4 ⟶ CuSO4 + Cu↓ + H2O
- восстанавливается до металлической меди типичными восстановителями, например гидросульфитом натрия в концентрированном растворе
2 Cu2O + 2NaHSO3 ⟶ 4Cu↓ + Na2SO4 + H2SO4
Реакции при высоких температурах
Оксид меди (I) восстанавливается до металлической меди в следующих реакциях:
- при нагревании до 1800 °C (разложение)
2 Cu2O → 1800∘C 4Cu + O2
- при нагревании в токе водорода, монооксида углерода, с алюминием
Cu2O + H2 → >250∘C 2Cu + H2O Cu2O + CO → 250−300∘C 2Cu + CO2 3 Cu2O + 2Al → 1000∘C 6Cu + Al2O3
- при нагревании с серой
2 Cu2O + 3S → >600∘C 2Cu2S + SO2 2 Cu2O + Cu2S → 1200−1300∘C 6Cu + SO2
Оксид меди (I) может быть окислен до соединений меди (II) в токе кислорода или хлора:
Также, при высоких температурах оксид меди (I) реагирует:
- с аммиаком (образуется нитрид меди (I) )
3 Cu2O + 2NH3 → 250∘C 2Cu3N + 3H2O
- c оксидами щелочных металлов и бария (образуются двойные оксиды)
Cu2O + M2O → 600−800∘C 2MCuO Cu2O + BaO → 500−600∘C BaCu2O2
Прочие реакции
Оксид меди (I) реагирует с азидоводородом:
- при охлаждении выпадает осадок азида меди (II)
Cu2O + 5HN3 → 10−15∘C 2Cu(N3)2↓ + H2O + NH3↑ + N2↑
- при комнатной температуре в токе азидоводородной кислоты выпадает осадок азида меди (I)
Cu2O + 2HN3 → 20−25∘C 2CuN3↓ + H2O
Получение
Оксид меди (I) может быть получен:
- нагреванием металлической меди при недостатке кислорода
4Cu + O2 → >200∘C 2 Cu2O
- нагреванием металлической меди в токе оксида азота (I) или оксида азота (II)
2Cu + N2O → 500−600∘C Cu2O + N2 4Cu + 2NO → 500−600∘C 2 Cu2O + N2
- нагреванием металлической меди с оксидом меди (II)
Cu + CuO → 1000−1200∘C Cu2O
- термическим разложением оксида меди (II)
4CuO → 1026−1100∘C 2 Cu2O + O2
- нагреванием сульфида меди (I) в токе кислорода
2Cu2S + 3O2 → 1200−1300∘C 2 Cu2O + 2SO2
В лабораторных условиях оксид меди (I) может быть получен восстановлением гидроксида меди (II) (например, гидразином):
Также, оксид меди(I) образуется в реакциях ионного обмена солей меди (I) с щелочами, например:
- в реакции йодида меди (I) с горячим концентрированным раствором гидроксида калия
2CuI + 2KOH ⟶ Cu2O ↓ + 2KI + H2O
- в реакции дихлорокупрата (I) водорода с разбавленным раствором гидроксида натрия
2H[CuCl2] + 4NaOH ⟶ Cu2O ↓ + 4NaCl + 3H2O
В двух последних реакциях не образуется соединения с составом, соответствующим формуле CuOH (гидроксид меди (I) ). Образование оксида меди (I) происходит через промежуточную гидратную форму переменного состава Cu2O ⋅ xH2O .
- Окисление альдегидов гидроксидом меди (II). Если к голубому осадку гидроксида меди (II) прилить раствор альдегида и смесь нагреть , то сначала появляется жёлтый осадок гидроксида меди (I):
R−CHO + 2Cu(OH)2 → t R−COOH + 2CuOH↓ + H2O при дальнейшем нагревании желтого осадка гидроксида меди (I) превращается в красный оксид меди (I): 2CuOH → t Cu2O + H2O
Применение
Оксид меди (I) применяется как пигмент для окрашивания стекла, керамики, глазурей; как компонент красок, защищающих подводную часть судна от обрастания; в качестве фунгицида.
Обладает полупроводниковыми свойствами, используется в меднозакисных вентилях.
Токсичность
Оксид меди (I) — умеренно токсичное вещество: LD50 470 мг/кг (для крыс перорально). Вызывает раздражение глаз, может вызывать раздражение кожи и дыхательных путей.
Очень токсично для водной среды: LC50 для Daphnia magna составляет 0,5 мг/л в течение 48 ч.
http://liveposts.ru/articles/education-articles/himiya/oksid-medi-2-himicheskaya-formula-i-svojstva
http://chem.ru/oksid-medi-i.html




