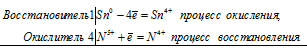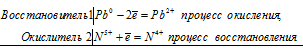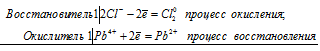Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e1ebd3acff37b6b • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Окислительно-восстановительные свойства олова и свинца
Задание 365
Какая степень окисления наиболее характерна для олова и, какая для свинца? Составьте электронные и молекулярные уравнения реакций олова и свинца с концентрированной азотной кислотой.
Решение:
Для олова в одинаковой степени характерны степени окисления +2 и +4. Для олова в одинаковой степени характерны степени окисления +2 и +4.
Для свинца наиболее характерна степень окисления +2 и в меньшей степени +4.
Уравнения реакций олова и свинца с концентрированной азотной кислотой:
а) При взаимодействии олова с концентрированной азотной кислотой образуются — оловянная кислота H2SnO3 и оксид азота (IV) NO2:
Sn 0 + 4N 5+ = Sn 4+ + 4N4 +
б) При взаимодействии свинца с концентрированной азотной кислотой образуются нитрат свинца Pb(NO3)2 и оксид азота (IV) NO2:
Pb 0 + 2N 5+ = Pb 2+ + 2N 4+
Задание 366
Чем можно объяснить восстановительные свойства олова (II) и окислительные свинца (IV)? На основании электронных уравнений составьте уравнения реакций: а) SnCl2 с НgCl2; б) РЬО2 с НСl (конц.).
Решение:
Олово и свинец на внешнем энергетическом уровне содержат по четыре электрона. Так как олово (II) на внешнем энергетическом уровне содержит два электрона, то оно может их отдать, т. е. проявить свойства восстановителя. Свинец (IV) на внешнем энергетическом уровне не содержит электронов, поэтому свинец (IV) может присоединить недостающие электроны, проявив при этом свойства окислителя. Свинец в степени окисления +4 может только присоединять электроны, поэтому проявляет только свойства окислителя, олово в степени окисления +2 может и отдавать, и присоединять по два электрона, проявляя при этом свойства или восстановителя, или окислителя.
а) Реакция SnCl2 с НgCl2
Sn 2+ + 2Hg 2+ = Sn 4+ + 2Hg +
б) Реакция РЬО2 с НСl (конц.).
Pb 4+ + 2Cl — = Pb 2+ + Cl2 0
Задание 367
Какие оксиды и гидроксиды образуют олово и свинец? Как изменяются их кислотно-основные и окислительно-восстановительные свойства в зависимости от степени окисления элементов? Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия раствора гидроксида натрия: а) с оловом; б) с гидроксидом свинца (II).
Решение:
Олово и свинец образуют оксиды и диоксиды: PbO, PbO2, SnO, SnO2.
SnO и PbO образуют гидроксиды Sn(OH)2 и Pb(OH)2, которые проявляют амфотерные свойства. У Pb(OH)2 преобладают основные свойства, он растворяется только в концентрированном растворе щёлочи. У Sn(OH)2 преобладают кислотные свойства.
Оксидам PbO2 и SnO2 отвечают гидроксиды H2SnO3 и H2PbO3 – слабые кислоты. Причём кислотные свойства их ослабевают в ряду H2SnO3 — H2PbO3. Основные свойства в ряду Sn(OH)2 — Pb(OH)2 усиливаются.
Уравнения реакции взаимодействия раствора гидроксида натрия: а) с оловом; б) с гидроксидом свинца (II):
а) Sn +2NaOH + 4H2O = Na2[Sn(OH)6] + 2H2↑ (молекулярная форма);
Sn + 2OH – + 4H2O = [Sn(OH)6] 2- + 2H2↑ (ионно-молекулярная форма)
б) Pb(OH)2 + 2NaOH = Na2[Pb(OH)4] (молекулярная форма);
Pb(OH)2 + 2OH — = [Pb(OH)4] 2- (ионно-молекулярная форма).
Олово и свинец (стр. 4 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 |
Как и все соединения двухвалентного олова, станниты проявляют сильные восстановительные свойства и легко окисляются под действием различных окислителей:
Станнаты – это кислородсодержащие соли, в которых четырехвалентное олово входит в состав кислотного остатка. Как и в случае подобных соединений двухвалентного олова, станнаты бывают двух типов: безводные с общей формулой Me2SnO3 (где Me – одновалентный металл) и комплексные Me2[Sn(OH)6].
Проще получаются безводные станнаты – необходимо диоксид олова обработать расплавом щелочи или растворить оловянную кислоту в водном растворе сильного основания:
Комплексные станнаты образуются при растворении металлического олова в кипящих концентрированных растворах щелочей или при окислении гидроксостаннитов:
При комнатной температуре оба вида станнатов устойчивы, но при нагревании комплексные соли отщепляют воду и превращаются в безводные:
Поскольку станнаты являются производными от слабой кислоты, они легко разлагаются более сильными кислотами, причем добавление разбавленных кислот приводит к выпадению осадка оловянной кислоты, а концентрированных кислот – к образованию солей четырехвалентного олова:
Восстановительных свойств станнаты не могут проявлять в принципе, так как для олова валентность IV является максимальной. А окислительные свойства для них не характерны, поэтому даже длительное нагревание в присутствии восстановителей не приводит в большинстве случаев к восстановлению олова, входящего в состав станнатов, до двухвалентного или металлического состояния.
Свинец способен проявлять валентности II и IV, но в отличие от олова он в подавляющем большинстве случаев двухвалентен. Соединения четырехвалентного свинца получаются с большим трудом и проявляют сильные окислительные свойства.
Оксид свинца (II) (свинцовый глет) PbO образуется в результате непосредственного соединения простых веществ либо термического разложения гидроксида или некоторых кислородсодержащих солей двухвалентного свинца:
Он представляет собой кристаллическое или аморфное вещество (в зависимости от способа получения), чаще всего окрашенное в желтый цвет, хотя в ряде случаев образуется серая модификация. Оксид свинца (II) легко реагирует с кислотами, с щелочами реакция идет в незначительной мере:
Следовательно, PbO является амфотерным оксидом с преобладанием основных свойств. Необходимо отметить, что оксид свинца (II) взаимодействует только с теми кислотами, с которыми он образует хорошо или умеренно растворимые соли. В противоположном случае на поверхности оксида образуется пленка из плохо растворимой соли, препятствующей дальнейшему протеканию реакции.
Из-за своей амфотерности оксид двухвалентного свинца может соединяться как с кислотными оксидами, так и с оксидами щелочных или щелочноземельных металлов:
С водой оксид свинца (II), как и все оксиды малоактивных металлов, не взаимодействует ни при обычных условиях, ни при повышенных температурах.
Осторожно нагревая PbO на воздухе до 400-500оС, его можно частично окислить и перевести в промежуточный оксид Pb3O4, в молекуле которого два атома свинца находятся в двухвалентном состоянии, а один – в четырехвалентном:
Зато при нагревании вместе с такими восстановителями, как водород, углерод, угарный газ, он легко восстанавливается до металла:
Оксид свинца (IV) PbO2 получают окислением солей двухвалентного свинца хлором, бромом в щелочной среде или разложением промежуточного оксида Pb3O4 под действием азотной кислоты:
Диоксид свинца представляет собой черный порошок, нерастворимый в воде, но незначительно растворимый в некоторых кислотах. Гораздо лучше он соединяется с расплавленными щелочами или с оксидами активных металлов:
С водными растворами щелочей реакция идет медленнее:
Следовательно, оксида свинца (IV) обладает амфотерными свойствами с преобладанием кислотного характера.
Термически PbO2 неустойчив и при нагревании начинает отщеплять кислород, превращаясь либо в промежуточный оксид Pb3O4, либо в оксид двухвалентного свинца PbO:
Но, пожалуй, самыми важными для диоксида свинца являются его сильные окислительные свойства. Большинство веществ окисляются оксидом четырехвалентного свинца при комнатной температуре или при незначительном нагревании: концентрированная соляная кислота – до газообразного хлора; соли двухвалентного марганца – до марганцевой кислоты; соли трехвалентного хрома – до хромовой кислоты и т. д.:
Если диоксид свинца растирать с легко воспламеняющимися веществами, то реакция сопровождается появлением пламени.
Промежуточный оксид свинца (свинцовый сурик) имеет состав Pb3O4 и представляет собой соединение, в котором два атома свинца проявляют валентность II, а один – IV. Поэтому его формулу иногда записывают как 2PbO∙PbO2. С другой точки зрения, поскольку для двухвалентного свинца более характерны основные свойства, а для четырехвалентного – кислотные, промежуточный оксид можно рассматривать как свинцовую соль ортосвинцовой кислоты – ортоплюмбат свинца (II) Pb2PbO4.
Получают Pb3O4 окислением оксида двухвалентного свинца кислородом воздуха при температурах 400-500оС или частичным разложением оксида четырехвалентного свинца при 300-400оС:
Сурик представляет собой ярко-красный порошок, нерастворимый в воде. При прокаливании выше 500оС он начинает разлагаться с выделением кислорода, превращаясь в оксид двухвалентного свинца (реакция, обратная получению сурика из PbO).
С неокисляемыми кислотами и щелочами промежуточный оксид, как правило, не взаимодействует, зато он разлагается азотной кислотой до нитрата свинца (II) и диоксида свинца:
Поскольку в состав сурика входит четырехвалентный свинец, Pb3O4 проявляет сильные окислительные свойства, например сульфиты под действием сурика переходят в сульфаты; нитриты – в нитраты и т. д.:
Гидроксид свинца(II) Pb(OH)2 является слабым основанием, которое выпадает в виде белого осадка при добавлении разбавленных щелочей к растворам солей двухвалентного свинца:
Концентрированных растворов щелочей стараются избегать, иначе образующийся гидроксид свинца будет связываться избытком сильного основания в хорошо растворимое комплексное соединение – тетрагидроксоплюмбат(II).
Являясь амфотерным соединением, гидроксид свинца (II) реагирует как с сильными кислотами, так и с концентрированными щелочами:
http://buzani.ru/zadachi/khimiya-shimanovich/979-olovo-i-svinets-zadaniya-361-364
http://pandia.ru/text/80/193/57081-4.php