Нитрат кальция: способы получения и химические свойства
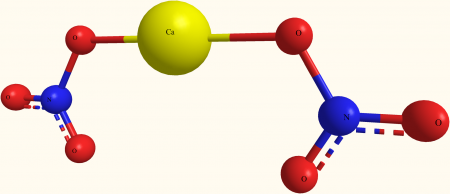
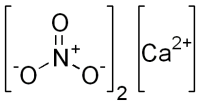
Нитрат кальция Ca(NO3)2 — соль щелочного металла кальция и азотной кислоты. Белый, при нагревании разлагается. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 164,09; относительная плотность для тв. и ж. состояния d = 2,36; tпл = 561º C (разлагается).
Способ получения
1. Нитрат кальция можно путем взаимодействия кальция и разбавленной азотной кислоты, образуется нитрат кальция, оксид азота (I) и вода:
если кальций будет взаимодействовать с очень разбавленной азотной кислотой , то на выходе будет образовываться нитрат кальция, нитрат аммония и вода:
2. В результате взаимодействия сульфида кальция и концентрированной азотной кислоты образуется нитрат кальция, сера, оксид азота (IV) и вода:
Качественная реакция
Качественная реакция на нитрат кальция — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат кальция образует сульфат кальция, нитрат меди, бурый газ оксид азота и воду:
Химические свойства
1. Hитрат кальция разлагается при температуре 450 — 500º С с образованием нитрита кальция и кислорода:
а если температуре поднимется выше 561 о С, то на выходе реакции будут образовываться оксид кальция, оксид азота (IV) и кислород:
2. Нитрат кальция реагирует с простыми веществами :
2.1. Нитрат кальция вступает в реакцию с атомным водородом (цинком и в присутствии соляной кислоты). В результате реакции образуется нитрат кальция и вода :
3. Возможны реакции между нитратом кальция и сложными веществами :
Нитрат кальция вступает в реакцию с cолями :
В результате реакции между нитратом кальция и гидрофосфатом натрия при кипении образуется фосфат кальция, азотная кислота и нитрат натрия:
Нитрат кальция ГОСТ 4142-77
| Нитрат кальция | |
|---|---|
 | |
 | |
 | |
| Традиционные названия | кальциевая селитра, норвежская селитра, азотнокислый кальций |
| Хим. формула | Ca(NO3)2 |
| Состояние | гранулы сферической формы белого, светло-серого, светло-бежевого цвета |
| Молярная масса | |
| Т. всп. | негорючая °C |
| Мол. теплоёмк. | 149,33 Дж/(моль·К) |
| Энтальпия образования | -937,2 кДж/моль |
| Растворимость в воде | Безводной: 121,2 г/100 мл (20 °C); 271,0 г/100 мл (40 °C); 359 г/100 мл (51,6 °C). Тетрагидрата: 102 г/100 мл (0 °C); 129 г/100 мл (20 °C); (100 °C) 363 г/100 мл |
| Растворимость в | спирте и ацетоне |
| Кристаллическая структура | |
| Рег. номер CAS | |
| PubChem | 24963 |
| Рег. номер EINECS | 233-332-1 |
| SMILES | |
| RTECS | EW2985000 |
| ChEBI | 64205 |
| Номер ООН | 1454 |
| ChemSpider | 23336 и 21500286 |
| ГОСТ | ГОСТ 4142-77 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Кальция нитрат (кальциевая селитра, азотнокислый кальций) — неорганическая соль азотной кислоты. Соединение сильно гигроскопично, поэтому его хранят без доступа влаги. Химическая формула Ca(NO3)2.
Содержание
- 1 Свойства
- 1.1 Физические свойства
- 1.2 Химические свойства
- 2 Получение
- 2.1 Реакции с получением нитрата кальция
- 3 Применение
- 3.1 В сельском хозяйстве
- 3.2 В пиротехнике
Свойства
Физические свойства
Химические свойства
При 500 °C начинает разлагаться с выделением O2 и образованием сначала Ca(NO2)2, а затем CaO и NO2. Кальциевая селитра при нормальных условиях негорючая, пожаро- и взрывобезопасная, устойчивая в интервале температур от −60 °C до +155 °C.
Получение
Получают кальция нитрат действием HNO3 на известняк или поглощением нитрозных газов (в основном NO2) известковым молоком. Применяют кальция нитрат как азотное удобрение и для получения особо чистого CaO.
Для получения гранулированной кальциевой селитры используется способ низкотемпературной нейтрализации азотной кислоты природным известняком или продуктами переработки известняка.
Реакции с получением нитрата кальция
Нитрат кальция производится путём обработки известняка с азотной кислотой, после нейтрализации аммиака:
Он также является побочным продуктом процесса Оддо при добыче фосфата кальция:
Так же как нитраты других щелочноземельных металлов и LiNO3, кальциевая селитра при нагревании разлагается на выпуске диоксида азота:
Также нитрат кальция можно получить проделав следующие реакции:
Также образование нитрата кальция возможно и за счет атмосферных явлений:
Применение
Гранулированный, безводный нитрат кальция, применяется как добавка в бетон, в качестве удобрения, для приготовления рассола в холодильной технике, в производстве реактивов, стеклопластиков, а также как один из компонентов для производства взрывчатки.
В сельском хозяйстве
Нитрат кальция является физиологическим щелочным удобрением, пригодным для всех почв и прежде всего для закисленных почв. В сельском хозяйстве применяют как азотное удобрение. Выпускают в гранулированном виде; товарный продукт должен содержать не менее 15,5 % азота, кроме того, к нему добавляют в процессе производства 4—7 % нитрата аммония для уменьшения гигроскопичности удобрения; содержание влаги не должно превышать 15 %. Нитрат кальция вносят под все культуры. Наиболее эффективен на кислых почвах, особенно для весенней подкормки озимых.
В пиротехнике
Несмотря на то, что нитрат кальция в смеси с горючими веществами способен давать недорогой источник кирпично-красного пламени, применение его в этом качестве крайне ограничено из-за сильной гигроскопичности.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de3f0f45aca3a95 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
http://chem.ru/nitrat-kalcija.html
http://gomolog.ru/reshebniki/9-klass/zadachnik-kuznecova-2020/4-39.html




