Реакция взаимодействия йодида платины (II) и кислорода
Реакция взаимодействия йодида платины (II) и кислорода
Уравнение реакции взаимодействия йодида платины (II) и кислорода:
Реакция взаимодействия йодида платины (II) и кислорода.
В результате реакции образуются оксид платины (IV) и йод.
Реакция протекает при условии: в среде кислорода, при повышенном давлении и температуре 400-500 °C.
Формула поиска по сайту: PtI2 + O2 → PtO2 + I2.
Реакция взаимодействия гафния и хлорида свинца (II)
Реакция взаимодействия бромной кислоты и гидроксида натрия
Реакция взаимодействия галлия и брома
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Платина
(молярная масса)
(первый электрон)
470 кДж/моль
гранецентрированная
Содержание
- 1 История
- 2 Происхождение названия
- 3 Нахождение в природе
- 3.1 Изотопы
- 3.2 Месторождения
- 4 Получение
- 5 Физические свойства
- 6 Химические свойства
- 6.1 Реакционная способность
- 6.2 Катализатор
- 7 Добыча и производство
- 8 Применение
- 8.1 В технике
- 8.2 В медицине
- 8.3 В ювелирном деле
- 8.4 Монетарная функция
- 8.5 Знаки отличия
История
В Старом Свете платина не была известна до середины XVI века, однако цивилизации Анд (инки и чибча) добывали и использовали её с незапамятных времён. Первыми европейцами, познакомившимися с платиной в середине XVI века, были конкистадоры. Считается, что первым в литературе упомянул о платине Скалигер в опубликованной в 1557 году книге «Экзотерические упражнения в 15 книгах», где он, полемизируя с Кардано о понятии «металл», рассказал о некоем веществе из Гондураса, которое нельзя расплавить. Вероятно, этим веществом и была платина.
В 1735 году испанский король издаёт указ, повелевающий платину впредь в Испанию не ввозить. При разработке россыпей в Колумбии повелевалось тщательно отделять её от золота и топить под надзором королевских чиновников в глубоких местах речки Рио-дель-Пинто (приток Рио-Сан-Хуан (англ.) русск. ), которую стали именовать Платино-дель-Пинто. А ту платину, которая уже привезена в Испанию, повелевалось всенародно и торжественно утопить в море. Королевское распоряжение было отменено через 40 лет, когда мадридские власти приказали доставлять платину в Испанию, чтобы самим фальсифицировать золотые и серебряные монеты. В 1820 году в Европу было доставлено от 3 до 7 тонн платины. Здесь с нею познакомились алхимики, считавшие самым тяжёлым металлом золото. Необычайно плотная платина оказалась тяжелее золота, поэтому алхимики посчитали её непригодным металлом и наделили адскими чертами. Некоторое применение платина нашла позже во Франции, когда из неё был изготовлен эталон метра, а позже эталон килограмма.
Согласно некоторым источникам, испанский математик и мореплаватель А. де Ульоа в 1744 году привёз образцы платины в Лондон, он поместил описание платины в своём отчёте о путешествии в Южную Америку, опубликованном в 1748 году. В 1789 А. Лавуазье включил платину в список простых веществ. Впервые в чистом виде из руд платина была получена английским химиком У. Волластоном в 1803 году.
В России ещё в 1819 году в россыпном золоте, добытом на Урале, был обнаружен «новый сибирский металл», который сначала называли белым золотом. Платина встречалась на Верх-Исетских, а затем и на Невьянских и Билимбаевских приисках. Богатые россыпи платины были открыты во второй половине 1824 года, а на следующий год в России началась её добыча. В 1826 году П. Г. Соболевский и В. В. Любарский изобрели метод выработки ковкой платины с помощью прессования и последующей выдержки в раскалённом добела состоянии.
Происхождение названия
Название платине было дано испанскими конкистадорами, которые в середине XVI в. впервые познакомились в Южной Америке (на территории современной Колумбии) с новым металлом, внешне похожим на серебро (исп. plata ). Слово буквально означает «маленькое серебро», «серебришко». Объясняется такое пренебрежительное название исключительной тугоплавкостью платины, которая не поддавалась переплавке, долгое время не находила применения и ценилась вдвое ниже, чем серебро.
Нахождение в природе
Изотопы
Природная платина встречается в виде смеси из шести изотопов: 190 Pt (0,014 %), 192 Pt (0,782 %), 194 Pt (32,967 %), 195 Pt (33,832 %), 196 Pt (25,242 %), 198 Pt (7,163 %). Один из них слабо радиоактивен ( 190 Pt, альфа-распад в 186 Os, период полураспада 6,5⋅10 11 лет ). Предсказывается существование очень слабой радиоактивности ещё двух природных изотопов платины: альфа-распад 192 Pt→ 188 Os и двойной бета-распад 198 Pt→ 198 Hg, однако пока экспериментально эти распады не зарегистрированы; установлено лишь, что периоды полураспада превышают соответственно 4,7×10 16 лет и 3,2×10 14 лет .
Месторождения
Платина является одним из самых редких металлов: её среднее содержание в земной коре (кларк) составляет 5⋅10 −7 % по массе. Даже так называемая самородная платина является сплавом, содержащим от 75 до 92 процентов платины, до 20 процентов железа, а также иридий, палладий, родий, осмий, реже медь и никель.
Основная часть месторождений платины (более 90 %) заключена в недрах пяти стран. К этим странам относятся ЮАР (Бушвелдский комплекс), США, Россия, Зимбабве, Китай.
В России основными месторождениями металлов платиновой группы являются: Октябрьское, Талнахское и Норильск-1 сульфидно-медно-никелевые в Красноярском крае в районе Норильска (более 99 % разведанных и более 94 % оцененных российских запасов), Фёдорова Тундра (участок Большой Ихтегипахк) сульфидно-медно-никелевое в Мурманской области, а также россыпные Кондёр в Хабаровском крае, Левтыринываям в Камчатском крае, реки Лобва и Выйско-Исовское в Свердловской области. Крупнейшим платиновым самородком, найденным в России, является «Уральский гигант» массой 7860,5 г , обнаруженный в 1904 г. на Исовском прииске; в настоящее время хранится в Алмазном фонде.
Получение
Самородную платину добывают на приисках (см. подробнее в статье Благородные металлы), менее богаты рассыпные месторождения платины, которые разведываются, в основном, способом шлихового опробования.
Производство платины в виде порошка началось в 1805 году английским ученым У. Х. Волластоном из южноамериканской руды.
Сегодня платину получают из концентрата платиновых металлов. Концентрат растворяют в царской водке, после чего добавляют этанол и сахарный сироп для удаления избытка HNO3. При этом иридий и палладий восстанавливаются до Ir 3+ и Pd 2+ . Последующим добавлением хлорида аммония выделяют гексахлороплатинат (IV) аммония (NH4)2PtCl6. Высушенный осадок прокаливают при 800—1000 °C:
Получаемую таким образом губчатую платину подвергают дальнейшей очистке повторным растворением в царской водке, осаждением (NH4)2PtCl6 и прокаливанием остатка. Затем очищенную губчатую платину переплавляют в слитки. При восстановлении растворов солей платины химическим или электрохимическим способом получают мелкодисперсную платину — платиновую чернь.
Физические свойства
Серовато-белый пластичный металл, температуры плавления и кипения — 2041,4 K ( 1768,3 °C ) и 4098 K ( 3825 °C ) соответственно, удельное электрическое сопротивление — 0,098 мкОм·м (при 0 °С ). Платина — один из самых тяжёлых (плотность 21,09—21,45 г/см³ ; атомная плотность 6,62⋅10 22 ат/см³ ) металлов. Твёрдость по Бринеллю — 50 кгс/мм 2 (по Моосу 3,5).
Кристаллическая решётка кубическая гранецентрированная, а = 0,392 нм , Z = 4 , пространственная группа Fm3m .
Платина устойчива к вакууму и может применяться в космической технике.
Химические свойства
По химическим свойствам платина похожа на палладий, но проявляет бо́льшую химическую устойчивость. При комнатной температуре реагирует с царской водкой:
Платина медленно растворяется в горячей концентрированной серной кислоте и жидком броме. Она не взаимодействует с другими минеральными и органическими кислотами. При нагревании реагирует со щелочами и пероксидом натрия, галогенами (особенно в присутствии галогенидов щелочных металлов):
При нагревании платина реагирует с серой, селеном, теллуром, углеродом и кремнием. Как и палладий, платина может растворять молекулярный водород, но объём поглощаемого водорода и способность его отдавать при нагревании у платины меньше.
При нагревании платина реагирует с кислородом с образованием летучих оксидов. Выделены следующие оксиды платины: чёрный PtO, коричневый PtO2, красновато-коричневый PtO3, а также Pt2O3 и смешанный Pt3O4, в котором платина проявляет степени окисления II и IV.
Для платины известны гидроксиды Pt(OH)2 и Pt(OH)4. Получают их при щелочном гидролизе соответствующих хлороплатинатов, например:
Эти гидроксиды проявляют амфотерные свойства:
Гексафторид платины PtF6 является одним из сильнейших окислителей среди всех известных химических соединений, способный окислить молекулы кислорода и ксенона:
Соединение O2 + [PtF6] − (гексафтороплатинат(V) диоксигенила) летуче и разлагается водой на фтороплатинат(IV), небольшое количество гидратированного диоксида платины и кислород с примесью озона.
С помощью гексафторида платины, в частности, канадский химик Нейл Бартлетт в 1962 году получил первое настоящее химическое соединение ксенона Xe[PtF6].
C обнаруженного Н. Бартлеттом взаимодействия между Хе и PtF6, приводящего к образованию Xe[PtF6], началась химия инертных газов. PtF6 получают фторированием платины при 1000 °C под давлением.
Фторирование платины при нормальным давлении и температуре 350—400 °C даёт фторид платины(IV):
Фториды платины гигроскопичны и разлагаются водой.
Тетрахлорид платины с водой образует гидраты PtCl4· n H2O, где n = 1, 4, 5 и 7 . Растворением PtCl4 в соляной кислоте получают платинохлористоводородные кислоты H[PtCl5] и H2[PtCl6].
Синтезированы такие галогениды платины, как PtBr4, PtCl2, PtCl2·2PtCl3, PtBr2 и PtI2.
Для платины характерно образование комплексных соединений состава [PtX4] 2- и [PtX6] 2- . Изучая комплексы платины, А. Вернер сформулировал теорию комплексных соединений и объяснил природу возникновения изомеров в комплексных соединениях.
Реакционная способность
Платина является одним из самых инертных металлов. Она нерастворима в кислотах и щелочах, за исключением царской водки. Платина также непосредственно реагирует с бромом, растворяясь в нём.
При нагревании платина становится более реакционноспособной. Она реагирует с пероксидами, а при контакте с кислородом воздуха — с щелочами. Тонкая платиновая проволока горит во фторе с выделением большого количества тепла. Реакции с другими неметаллами (хлором, серой, фосфором) происходят менее активно. При более сильном нагревании платина реагирует с углеродом и кремнием, образуя твёрдые растворы, аналогично металлам группы железа.
В своих соединениях платина проявляет почти все степени окисления от 0 до +6, из которых наиболее устойчивы +2 и +4. Для платины характерно образование многочисленных комплексных соединений, которых известно много сотен. Многие из них носят имена изучавших их химиков (соли Косса, Магнуса, Пейроне, Цейзе, Чугаева и т. д.). Большой вклад в изучение таких соединений внес русский химик Л. А. Чугаев (1873−1922), первый директор созданного в 1918 году Института по изучению платины.
Катализатор
Платина, особенно в мелкодисперсном состоянии, является очень активным катализатором многих химических реакций, в том числе используемых в промышленных масштабах. Например, платина катализирует реакцию присоединения водорода к ароматическим соединениям даже при комнатной температуре и атмосферном давлении водорода. Ещё в 1821 немецкий химик И. В. Дёберейнер обнаружил, что платиновая чернь способствует протеканию ряда химических реакций; при этом сама платина не претерпевала изменений. Так, платиновая чернь окисляла пары винного спирта (этанола) до уксусной кислоты уже при обычной температуре. Через два года Дёберейнер открыл способность губчатой платины при комнатной температуре воспламенять водород. Если смесь водорода и кислорода (гремучий газ) ввести в соприкосновение с платиновой чернью или с губчатой платиной, то сначала идет сравнительно спокойная реакция горения. Но так как эта реакция сопровождается выделением большого количества теплоты, платиновая губка раскаляется, и гремучий газ взрывается. На основании своего открытия Дёберейнер сконструировал «водородное огниво» — прибор, широко применявшийся для получения огня до изобретения спичек.
Добыча и производство
До 1748 г. платина добывалась и производилась только на территории Америки, а в Старом Свете не была известна.
Когда платину стали завозить в Европу, её цена была вдвое ниже серебра. Ювелиры очень быстро обнаружили, что платина хорошо сплавляется с золотом, а так как плотность платины выше, чем у золота, то незначительные добавки платины позволили изготавливать подделки, которые невозможно было отличить от золотых изделий. Такого рода подделки получили столь широкое распространение, что испанский король приказал прекратить ввоз платины, а оставшиеся запасы утопить в море. Этот закон просуществовал до 1778 года. После отмены закона потребность в платине была небольшой, её использовали в основном для создания химического оборудования, приспособлений и в качестве катализаторов. Добываемой в Америке платины для этих целей было достаточно. Ни о каком значимом промышленном производстве говорить не приходилось.
В 1819 году платину впервые обнаружили на Урале близ Екатеринбурга, а в 1824 г. были открыты платиновые россыпи в Нижнетагильском округе. Разведанные запасы платины были столь велики, что Россия почти сразу заняла первое место в мире по добыче этого металла. Только в 1828 году в России было добыто 1,5 т платины — больше, чем за 100 лет в Южной Америке. На Урале появились целые платинодобывающие районы, из которых наиболее важными в промышленном отношении стали Исовской и Тагильский.
К концу XIX века в Российской империи добывалось платины в 40 раз больше, чем во всех остальных странах мира. Причём представлена она была и весьма увесистыми самородками. Например, у одного из найденных на Урале самородков масса составляла 9,639 кг , впоследствии он был переплавлен.
К середине XIX в. в Англии и Франции были проведены обширные исследования по аффинажу платины. В 1859 году французский химик Анри Этьен Сент-Клер Девиль впервые разработал промышленный способ получения слитков чистой платины. С этого времени почти вся добываемая на Урале платина скупалась английскими и французскими фирмами, в частности, «Джонсон, Маттей и К°». Позже к закупкам платины у Российской империи подключились американские и немецкие компании.
Даже после значительных зарубежных закупок большая часть добываемой Россией платины не находила достойного применения. Поэтому начиная с 1828 года, по предложению министра финансов Егора Канкрина, в Российской империи начали выпускать платиновые монеты номиналом 3, 6 и 12 рублей . При этом 12-рублёвая платиновая монета имела массу 41,41 г , а в рублёвой серебряной монете было 18 г чистого серебра. То есть по стоимости металла платиновые монеты были дороже серебряных в 5,2 раза . С 1828 по 1845 гг. было выпущено 1 372 000 трёхрублёвых монет, 17 582 шестирублёвых и 3303 двенадцатирублёвых общей массой 14,7 т . Основную выгоду от добычи получали владельцы рудников — Демидовы. Только в 1840 было добыто 3,4 т платины. В 1845 году, по настоянию нового министра финансов Фёдора Вронченко выпуск платиновых монет был прекращён, и все они были срочно изъяты из обращения. Основной версией столь поспешного шага считается повышение европейских цен на платину, в результате которого монеты стали стоить дороже номинала. После прекращения чеканки монет добыча платины в Российской империи упала в 20 раз . Все же к 1915 году на долю России приходилось 95 % от мировой добычи платины. Оставшиеся 5 % добычи осуществляла Колумбия. Причём почти вся российская платина поступала на экспорт. Например, в 1867 году Англия скупила весь запас российской платины — более 16 т .
К концу XIX в. Российская империя добывала 4,5 тонны платины в год.
До Первой мировой войны второй после Российской империи страной по объёмам добычи платины была Колумбия; с 1930-х гг. стала Канада, а после Второй мировой войны — Южная Африка.
В 1952 году Колумбия добыла 0,75 т платины, США — 0,88 т , Канада — 3,75 т , а Южно-Африканский Союз — 7,2 т . В СССР данные по добыче платины были засекречены.
В 2014 году в мире была добыта 161 т платины. Лидерами добычи были:
- ЮАР — 110,0 т,
- Россия — 25,0 т,
- Зимбабве — 11,0 т,
- Канада — 7,2 т,
- США — 3,7 т.
Лидером добычи платины в России является ГМК «Норильский никель».
Кроме того, на территории Хабаровского края располагается прииск Кондёр, который является крупнейшим в мире россыпным месторождением платины; его разработку ведёт Артель старателей «Амур» (входит в Группу компаний «Русская платина»), по итогам 2011 года на прииске добыто около 3,7 тонны платины.
Разведанные мировые запасы металлов платиновой группы составляют около 80 000 т и распределены, в основном, между ЮАР (87,5 %), Россией (8,3 %) и США (2,5 %).
Реферат: Химия платины и ее соединений
| Название: Химия платины и ее соединений Раздел: Рефераты по химии Тип: реферат Добавлен 09:16:44 18 июня 2005 Похожие работы Просмотров: 1780 Комментариев: 18 Оценило: 4 человек Средний балл: 5 Оценка: неизвестно Скачать | ||||
| 0 | 4 | Тетраэдр | ||
| +2 | 4 | Тетраэдр | ||
| +2 | 4 | Квадрат | ||
| +2 | 6 | Октаэдр | ||
| +4 | 6 | Октаэдр | ||
| +6 | 6 | Октаэдр | ||
| 0 | 4 | Тетраэдр | ||
| +2 | 4 | Квадрат | ||
| +4 | 6 | Октаэдр | ||
| +6 | 6 | Октаэдр |
| Рис. 3. Молярная электрическая проводимость соединений Pt (IV) в зависимости от их состава |






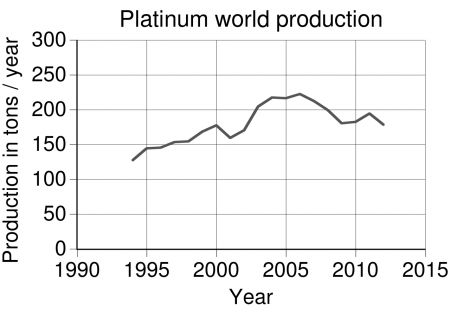
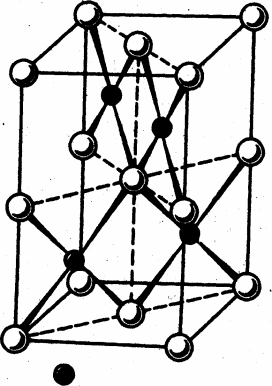 Рис. 1. Структура PtO и PtS
Рис. 1. Структура PtO и PtS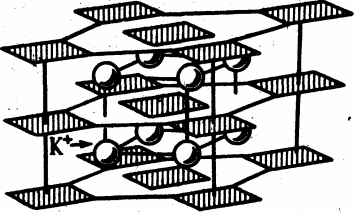 Рис 2. Структура K 2 [PtCl 4 ]
Рис 2. Структура K 2 [PtCl 4 ]




