Поставки полимеров пластиковой и выдувной тары
Полибутен -1: кто на новенького?
Когда мы говорим о полиолефинах, речь, как правило, идет о полипропилене и полиэтилене — двух самых распространенных в мире материалах. Однако ряд полиолефинов отнюдь не ограничивается привычными ПП и ПЭ.
Компания Basell разработала уникальный продукт, не имеющий аналогов в Европе, — новый полиолефиновый материал Polybutene-1 (Полибутен-1, ПБ-1). Именно о нем мы и хотели бы рассказать Вам сегодня.
Что такое Полибутен-1?
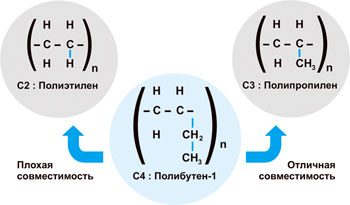
Прежде всего, оговоримся, под Полибутеном-1 мы не имеем в виду поли-изобутилен, который является жидким полимером. ПБ-1 твердый, выпускается в виде гранул, как и его «собратья» — ПП и ПЭ. ПБ-1 — полукристалличный, изотактический термопласт, получаемый путем полимеризации бутена-1. На рисунке 1 в сравнении представлена химическая структура различных материалов: полиэтилена, полипропилена и ПБ-1.
Рис. 1:
Сочетание Полибутена-1 с полиолефинами
ПБ-1 и ПП: благодаря своей структуре, ПБ-1 хорошо диспергируется в полипропилене, прекрасно с ним сочетаясь. При этом ПБ-1 модифицирует свойства ПП даже при низкой концентрации. В частности, придает гибкость и снижает температуру сварки материала. Этим и обусловлено распространенное применение ПБ-1 в смесях с ПП.
ПБ-1 и ПЭ: с полиэтиленом Полибутен-1 несовместим, так как образуется дисперсная фаза. Этот эффект несовместимости широко используется для модификации свойств ПЭ пленки (об этом см. ниже). Кроме того, ПБ-1 используется в смесях с другими полимерами как модификатор текучести и диспергирующий агент для улучшения механических свойств при повышенных температурах.
Свойства ПБ-1. Что делает его уникальным?
- стойкость к ползучести;
- ESCR (устойчивость к распространению трещин);
- реологические свойства ;
- возможность медленной кристаллизации;
- «контролируемая» совместимость с ПЭ;
- хорошее молекулярное взаимодействие (когезия);
- абразивная износостойкость;
- гибкость и сохранение физических свойств при температурах, близких к температуре плавления.
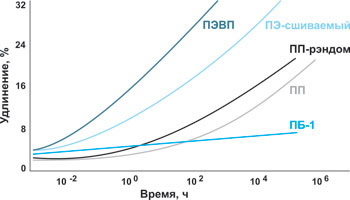
Рис. 2. Стойкость к деформации под нагрузкой ПБ-1 по сравнению с другими полиолефиновыми материалами:
По рисунку 2 видно, что ПБ-1 обладает высокой стойкостью к деформации под воздействием длительных нагрузок, значительно превосходящей показатели других полиолефиновых материалов.
Вышеперечисленные характеристики данного материала определяют сферу его использования на производстве.
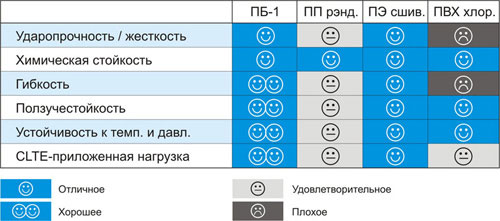
Рис. 3. Сравнение свойств различных материалов, применяющихся для производства труб:
Применения ПБ-1
Наиболее часто ПБ-1 используется в производстве высококачественных:
- труб;
- емкостей;
- котлов,
работающих под высоким давлением и/или при высоких температурах, а также при значительных абразивных нагрузках.
Трубы из ПБ-1 выгодно отличаются более низким весом, составляющим около 2/3 от массы труб, изготовленных из сшитого ПЭ и ПВХ.
Изделия из ПБ-1 также обладают:
- высокой гибкостью (в два раза выше, чем у «аналогов» из сшитого ПЭ, и в 10 раз выше, чем у труб из ПВХ);
- низкой потерей давления (в 2 раза меньше в сравнении со сшитым ПЭ).
На фотографиях показаны примеры применения ПБ-1 для изготовления труб центрального водоснабжения, обогрева пола и стен, промышленных труб и т. д.
Благодаря своим уникальным свойствам, ПБ-1 применяется не только для производства труб, но и:
- порошковых покрытий;
- мастербатчей;
- футеровки водонагревателей;
- пленок;
- и т. д.
Возможность замедленной кристаллизации — уникальное свойство для термопласта — делает возможным применение ПБ-1 в производстве волокон и термоплавких клеев. В любом случае, ПБ-1, присутствуя в небольшом соотношении, значительно улучшает свойства конечных изделий.
Особенно интересно такое применение ПБ-1, как легко открываемые упаковки (easy-open seel peal packaging). Сейчас разрабатываются все новые виды упаковки, соответствующие разнообразным требованиям покупателей, одно из которых — простота и легкость в использовании. По данным европейских исследователей более 91 % покупателей жалуются на проблемы с открыванием упаковки. Люди хотят, чтобы она открывалась легко и интуитивно.
.jpg)
И здесь ПБ-1 позволяет добиваться нужных результатов. Простота вскрытия упаковки из ПБ-1 основана на несовместимости ПБ-1 с ПЭ и совместимости с ПП. Благодаря присутствию диспергированной фазы ПБ-1, верхний слой пленки ровно и легко отслаивается при незначительном усилии.
Как видно из приведенных примеров, о каком бы применении ни шла речь, ПБ-1 предлагает эффективное решение. Добавляя небольшое количество ПБ-1 в базовый материал, производитель может получить более качественное, а порой и инновационное изделие. Развитие новых применений и новых марок ПБ-1 продолжается в научных центрах компании Basell и по сей день.
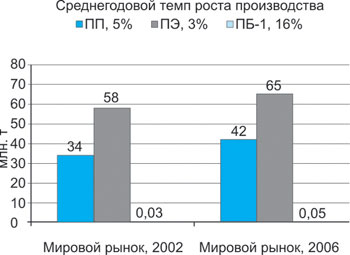
Рис. 4. Объемы производства полиолефинов:
Пока еще эта новейшая разработка не получила такого распространения, как ПП и ПЭ. На диаграмме рисунка 4 «столбик», отражающий объемы потребления Полибутена-1, даже не заметен по сравнению с такими признанными гигантами, как ПП и ПЭ. Однако важно отметить, что среднегодовой процент роста производства и потребления ПБ-1 в несколько раз выше (16%), чем у стандартных полиолефинов (3-5%). И уже можно с уверенностью говорить, что за материалом ПБ-1 — будущее.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Урок 9. |
 |


.jpg)
.jpg)
.jpg)

 -связи алкена и образовании на месте разрыва двух новых
-связи алкена и образовании на месте разрыва двух новых  -связей.
-связей.



 6СО2 + 6Н2О.
6СО2 + 6Н2О.





 350 °С в присутствии катализаторов отщепляется вода и образуются алкены:
350 °С в присутствии катализаторов отщепляется вода и образуются алкены:


 Моторные топлива, обладающие высокими октановыми числами, получают гидрированием разветвленных алкенов:
Моторные топлива, обладающие высокими октановыми числами, получают гидрированием разветвленных алкенов:















