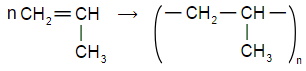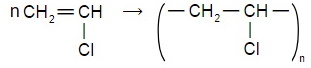Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de50b011e388e41 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
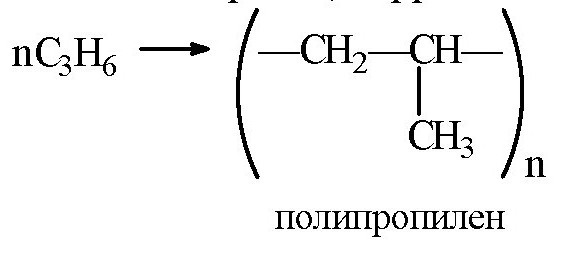
Полимеризация пропилена: схема, уравнение, формула
Что представляет собой полимеризация пропилена? Каковы особенности протекания данной химической реакции? Попробуем найти развёрнутые ответы на эти вопросы.
Характеристика соединений
Схемы реакций полимеризации этилена и пропилена демонстрируют типичные химические свойства, которыми обладают все представители класса олефинов. Такое необычное название данный класс получил от старого названия масла, используемого в химическом производстве. В 18 веке был получен хлористый этилен, который представлял собой маслянистое жидкое вещество.
Среди особенностей всех представителей класса непредельных алифатических углеводородов отметим наличие в них одной двойной связи.
Радикальная полимеризация пропилена объясняется именно присутствием в структуре вещества двойной связи.
Общая формула
У всех представителей гомологического ряда алкенов общая формула имеет вид СпН2п. Недостаточное количество водородов в структуре объясняет особенность химических свойств этих углеводородов.
Уравнение реакции полимеризации пропилена является прямым подтверждением возможности разрыва по такой связи при использовании повышенной температуры и катализатора.
Непредельный радикал называется аллилом или пропенилом-2. Зачем проводится полимеризация пропилена? Продукт этого взаимодействия применяется для синтеза синтетического каучука, который, в свою очередь, востребован в современной химической промышленности.
Физические свойства
Уравнение полимеризации пропилена подтверждает не только химические, но и физические свойства данного вещества. Пропилен является газообразным веществом с невысокими температурами кипения и плавления. Данный представитель класса алкенов имеет незначительную растворимость воде.
Химические свойства
Уравнения реакции полимеризации пропилена и изобутилена показывают, что процессы протекают по двойной связи. В качестве мономеров выступают алкены, а конечными продуктами такого взаимодействия будут полипропилен и полиизобутилен. Именно углерод-углеродная связь при подобном взаимодействии будет разрушаться, и в конечном итоге будет образовываться соответствующие структуры.
По двойной связи происходит образование новых простых связей. Как протекает полимеризация пропилена? Механизм данного процесса аналогичен процессу, протекающему у всех остальных представителей данного класса непредельных углеводородов.
Реакция полимеризации пропилена предполагает несколько вариантов протекания. В первом случае процесс осуществляется в газовой фазе. По второму варианту реакция идет в жидкой фазе.
Кроме того, полимеризация пропилена протекает и по некоторым устаревшим процессам, предполагающим применение в качестве реакционной среды насыщенного жидкого углеводорода.
Современная технология
Полимеризация пропилена в массе по технологии Spheripol представляет собой совмещение суспензионного реактора для изготовления гомополимеров. Процесс предполагает применение газофазного реактора с псевдожидкостным слоем для создания блок-сополимеров. В подобном случае реакция полимеризации пропилена предполагает добавление в устройство дополнительных совместимых катализаторов, а также проведение предварительной полимеризации.
Особенности процесса
Технология предполагает перемешивание компонентов в специальном устройстве, предназначенном для предварительного превращения. Далее эту смесь добавляют в петлевые полимеризационные реакторы, туда поступает и водород, и отработанный пропилен.
Работа реакторов осуществляется при диапазоне температур от 65 до 80 градусов по Цельсию. Давление в системе не превышает 40 бар. Реакторы, которые располагаются последовательно, применяются на заводах, рассчитанных на большие объемы изготовления полимерной продукции.
Из второго реактора удаляют полимерный раствор. Полимеризация пропилена предполагает перенос раствора в дегазатор повышенного давления. Здесь осуществляется удаление порошкового гомополимера от жидкого мономера.
Производство блоксополимеров
Уравнение полимеризации пропилена CH2 = CH — CH3 в данной ситуации имеет стандартный механизм протекания, есть отличия только в условиях осуществления процесса. Вместе с пропиленом и этеном порошок из дегазатора идет в газофазный реактор, работающий при температуре около 70 градусов по Цельсия и давлении не больше 15 бар.
Блок сополимеры после выведения из реактора поступают в специальную систему отведения от мономера порошкообразного полимера.
Полимеризация пропилена и бутадиенов ударопрочного вида допускает использование второго газофазного реактора. Он позволяет увеличивать уровень пропилена в полимере. Кроме того, возможно добавление в готовый продукт добавок, использование гранулирования, способствует повышению качества получаемого продукта.
Специфика полимеризации алкенов
Между изготовлением полиэтилена и полипропилена есть некоторые отличия. Уравнение полимеризации пропилена позволяет понять, что предполагается применение иного температурного режима. Кроме того, некоторые различия существуют и в конечной стадии технологической цепочки, а также в областях использования конечных продуктов.
Пероксид используют для смол, которые обладают отличными реологическими свойствами. У них повышенный уровень текучести расплавов, сходные физические свойства с теми материалами, которые имеют низкий показатель текучести.
Смолы, имеющие отличные реологические свойства, применяют в процессе литьевого формования, а также в случае изготовления волокон.
Для повышения прозрачности и прочности полимерных материалов производители стараются добавлять в реакционную смесь специальные кристаллизирующие добавки. Часть полипропиленовых прозрачных материалов замещают постепенно иными материалами в области выдувного формования и создания литья.
Особенности полимеризации
Полимеризация пропилена в присутствии активированного угля протекает быстрее. В настоящее время применяется каталитический комплекс углерода с переходным металлом, основанный на адсорбционной способности углерода. В результате полимеризации получается продукт, имеющий отличные эксплуатационные характеристики.
В качестве основных параметров процесса полимеризации выступает скорость реакции, а также молекулярный вес и стереоизомерный состав полимера. Значение имеет и физическая и химическая природа катализатора, полимеризационная среда, степень чистоты составных частей реакционной системы.
Линейный полимер получается и в гомогенной, и в гетерогенной фазе, если идет речь об этилене. Причина заключается в отсутствии у данного вещества пространственных изомеров. Чтобы получить изотактический полипропилен, стараются использовать твердые хлориды титана, а также алюминийорганические соединения.
При применении комплекса, адсорбированного на кристаллическом хлориде титана (3), можно получать продукт с заданными характеристиками. Регулярность решетки носителя не является достаточным фактором для приобретения катализатором высокой стереоспецифичности. Например, в случае выбора иодида титана (3) наблюдается получение большего количества атактического полимера.
Рассмотренные каталитические компоненты имеют льюисовский характер, поэтому связаны с подбором среды. Самой выгодной средой является применение инертных углеводородов. Так как хлорид титана (5) является активным адсорбентом, в основном выбирают алифатические углеводороды. Как протекает полимеризация пропилена? Формула продукта имеет вид (-СН2-СН2-СН2-)п. Сам алгоритм реакции аналогичен протеканию реакции у остальных представителей данного гомологического ряда.
Химическое взаимодействие
Проанализируем основные варианты взаимодействия для пропилена. Учитывая, что в его структуре есть двойная связь, основные реакции протекают именно с ее разрушением.
Галогенирование протекает при обычной температуре. По месту разрыва сложной связи происходит беспрепятственное присоединение галогена. В результате данного взаимодействия образуется дигалогенпроизводное соединение. Труднее всего происходит йодирование. Бромирование и хлорирование протекает без дополнительных условий и энергетических затрат. Фторирование пропилена протекает со взрывом.
Реакция гидрирования предполагает использование дополнительного ускорителя. В качестве катализатора выступает платина, никель. В результате химического взаимодействия пропилена с водородом, образуется пропан – представитель класса предельных углеводородов.
Гидратация (присоединение воды) осуществляется по правилу В. В. Марковникова. Суть его состоит в присоединении по двойной связи атома водорода к тому углероду пропилена, который имеет его максимальное количество. При этом галоген будет прикрепляться к тому С, который имеет минимальное число водорода.
Для пропилена характерно горение в кислороде воздуха. В результате этого взаимодействия будет получаться два основных продукта: углекислого газа, водяного пара.
При действии на данное химическое вещество сильных окислителей, например, перманганата калия, наблюдается его обесцвечивание. Среди продуктов химической реакции будет двухатомный спирт (гликоль).
Получение пропилена
Все способы можно разделить на две основные группы: лабораторные, промышленные. В лабораторных условиях можно получить пропилен при отщеплении галогеноводорода от исходного галогеналкила при воздействии на них спиртового раствора гидроксида натрия.
Пропилен образуется при каталитическом гидрировании пропина. В лабораторных условиях данное вещество можно получить при дегидратации пропанола-1. В данной химической реакции применяют в качестве катализаторов фосфорную либо серную кислоту, оксид алюминия.
Как получают пропилен в больших объемах? В связи с тем, что в природе данное химическое вещество встречается редко, были разработаны промышленные варианты его получения. Самым распространенным является выделение алкена из продуктов нефтепереработки.
Например, осуществляется крекинг сырой нефти в специальном кипящем слое. Пропилен получают путем пиролиза бензиново фракции. В настоящее время выделяют алкен и из попутного газа, газообразны продуктов коксования угля.
Есть разнообразные варианты пиролиза пропилена:
- в трубчатых печах;
- в реакторе с применением кварцевого теплоносителя;
- процесс Лавровского;
- автотермический пиролиз по методу Бартломе.
Среди отработанных промышленных технологий необходимо отметить и каталитическое дегидрирование насыщенных углеводородов.
Применение
Пропилен имеет различные области применения, поэтому и производится в больших масштабах в промышленности. Своим появлением данный непредельный углеводород обязан работам Натты. В середине двадцатого века он, пользуясь каталитической системой Циглера, разработал технологию полимеризации.
Натта сумел получить стереорегулярный продукт, который был им назван изотактическим, поскольку в структуре метильные группы были расположены с одной стороны цепочки. Благодаря такому варианту «упаковки» полимерных молекул, получаемое полимерное вещество имеет отличные механические характеристики. Полипропилен используется для изготовления синтетического волокна, востребован в качестве пластической массы.
Примерно десять процентов нефтяного пропилена потребляется для производства его оксида. До середины прошлого века данное органическое вещество получали хлоргидринным методом. Реакция протекала через образование промежуточного продукта пропиленхлоргидрина. У такой технологии есть определенные недостатки, которые связаны с использованием дорогостоящего хлора и гашеной извести.
В наше время на смену этой технологии пришел халкон-процесс. Он основывается на химическом взаимодействии пропена с гидропероксидами. Применяют оксид пропилена в синтезе пропиленглиголя, идущий на изготовление пенополиуретанов. Они считаются отличными амортизирующими материалами, поэтому идут на создание упаковок, ковриков, мебели, теплоизоляционных материалов, сорбирующих жидкостей и фильтрующих материалов.
Кроме того, среди основных сфер применения пропилена необходимо упомянуть синтез ацетона и изопропилового спирта. Изопропиловый спирт, являясь отличным растворителем, считается ценным химическим продуктом. В начале двадцатого века этот органический продукт получали сернокислотным методом.
Кроме того, отработана технология прямой гидратации пропена с введением в реакционную смесь кислых катализаторов. Около половины всего производимого пропанола уходит на синтез ацетона. Данная реакция предполагает отщепление водорода, проводится при 380 градусах по Цельсия. Катализаторами в этом процессе выступают цинк и медь.
Среди важных отраслей применения пропилена особое место занимает гидроформилирование. Пропен идет на производство альдегидов. Оксисинтез в нашей стране стали использовать с середины прошлого века. В настоящее время эта реакция занимает важное место в нефтехимии. Химическое взаимодействие пропилена с синтез-газом (смесью угарного газа и водорода) при температуре 180 градусов, катализаторе оксиде кобальта и давлении в 250 атмосфер наблюдается образование двух альдегидов. Один имеет нормальное строение, у второго – изогнутая углеродная цепочка.
Сразу после открытия данного технологического процесса, именно эта реакция стала объектом исследований для многих ученых. Они искали способы смягчения условий ее протекания, старались снизить процентное содержание в получаемой смеси альдегида разветвленного строения.
Для этого были придуманы экономичные процессы, предполагающие применение иных катализаторов. Удалось снизить температуру, давление, увеличить выход альдегида линейного строения.
Эфиры акриловой кислоты, которые также связаны с полимеризацией пропилена, применяют в качестве сополимеров. Около 15 процентов нефтехимического пропена применяют в качестве исходного вещества для создания акрионитрила. Этот органический компонент необходим для изготовления ценного химического волокна – нитрона, создания пластических масс, производства каучуков.
Заключение
Полипропилен считают в настоящее время крупнейшим производством нефтехимии. Спрос на этот качественный и недорогой полимер растет, поэтому он постепенно вытесняет полиэтилен. Он незаменим при создании жесткой упаковки, пластин, пленок, автомобильных деталей, синтетической бумаги, канатов, ковровых деталей, а также для создания разнообразного бытового оборудования. В начале двадцать первого века производство полипропилена занимало второе место в полимерной промышленности. Учитывая запросы различных отраслей промышленности, можно сделать вывод: в ближайшее время сохранится тенденция масштабного производства пропилена и этилена.
Уравнение реакции полимеризации пропена 1 хлорэтана
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Определите молекулярную формулу алкена, молярная масса которого в три раза больше, чем у этилена.
Дано: M(CnH2n)/M(C2H4)=3
Найти: формулу CnH2n — ?
Решение
M(CnH2n)=3•M(C2H4)=3•28 г/моль=84 г/моль
M(CnH2n)=n • Ar(C)+2n • Ar(H)=n • 12+2n • 1=14 n
Имеем уравнение: 14n=84, n=84:14=6, следовательно формула имеет вид C6H12
Ответ: C6H12
Задание 2
Назовите этиленовый углеводород по международной номенклатуре. 2-метилпропен
Задание 3
Каковы основные источники промышленного получения этиленовых углеводородов? Крекинг нефти (термический, каталитический) и пиролиз (сильное нагревание) алканов.
Задание 5
Как отличить друг от друга этан и этилен? Этилен, в отличие от этана, обесцвечивает бромную воду и раствор перманганата калия.
Напишите уравнение реакции.
CH2=CH2 + Br2 H₂O ⟶ BrCH2 — CH2Br
CH2=CH2 + [O] + H2O ⟶ CH2OH — CH2OH
Задание 6
В чём состоит основное отличие химических свойств предельных и непредельных углеводородов? Непредельные углеводороды, в отличие от предельных, способны к реакциям присоединения по кратной связи.
Задание 7
Напишите уравнения реакций пропена с водородом, бромом, хлороводородом и водой. Помните, что присоединение несимметричных реагентов происходит по правилу Марковникова.
CH3 — CH=CH2 + H2 кат. ⟶ CH3 — CH2 — CH3
CH3 — CH=CH2 + Br2 ⟶ CH3 — CHBr — CH2Br
CH3 — CH=CH2 + HCl ⟶ CH3 — CHCl — CH3
Задание 8
С каким жидким веществом при обычных условиях реагируют как алканы, так и алкены? С бромом.
Чем отличаются эти реакции? Реакция брома с алканами является реакцией замещения, а с алкенами — реакцией присоединения.
Задание 9
Объясните, почему химические свойства полиэтилена отличаются от свойств этилена. Полиэтилен, в отличие от этилена, не содержит кратных связей, поэтому для него характерны химические свойства предельных алканов.
Задание 10
Напишите уравнение реакции полимеризации:
а) пропена;
б) 1-хлорэтена.
Задание 11
Используя Интернет, подготовьте сообщение об областях применения и свойствах одного из полимеров:
1) полиэтилен,
Применение: производство плёнки, различной тары, труб, электроизоляции, термоклея, брони.
Свойства: малопрозрачное вещество, значительно легче воды (плотность примерно 0,92 г/см 3 ) , плохо проводит теплоту и электрический ток, при нагревании размягчается (80°C—120°C) , на ошупь немного жирный, напоминает парафин.
2) полипропилен,
Применение: производство мешков, тары, труб, деталей технической аппаратуры, пластиковых стаканчиков, плёнки для парников, теплиц, предметов домашнего обихода, нетканых материалов, электроизоляционного материала, в строительстве для вибро- и шумоизоляции.
Свойства: обладает большей механической прочностью (стойкий к стиранию) , более термостойкий (начинает размягчаться при 140°С, температура плавления 175°С) , почти не подвергается коррозионному растрескиванию.
3) поливинилхлорид.
Применение: производство линолеума, изоляционной ленты, непромокаемых плащей, искусственных кож, поливинилхлоридного волокна, грязезащитных ковриков, обувных пластикатов, мебельной кромки.
Свойства: отличается химической стойкостью к щелочам, минеральным маслам, многим кислотам и растворителям, в чистом виде не поддерживает горение на воздухе, обладает малой морозостойкостью (-15°C) и нагревостойкостью (66°C) .
Задание 12
При взаимодействии этилена с бромом образовалось 37,6 г дибромэтана. Какой объём этилена (н.у.) вступил в реакцию?
Дано: m(C2H4Br2)=37,6 г
Найти: V(C2H4)-?
Решение
1-й способ
Mr(C2H4Br2)=2•Ar(C)+4•Ar(H)+2•Ar(Br)= 2•12+4•1+2•80= 188, поэтому M(C2H4Br2)=1 88 г/моль
n( C2H4Br2 )=m( C2H4Br2 )/M( C2H4Br2 )=37,6 г : 188 г/моль=0,2 моль
Составляем уравнение реакции: C2H4 + Br2 ⟶ C2H4Br2
По уравнению реакции n(C2H4)/1=n(C2H4Br2)/1, поэтому
n( C2H4 )=n( C2H4Br2 )=0,2 моль
V( C2H4 )=n( C2H4 )•Vm=0,2 моль • 22,4 л/моль=4,48 л
2-й способ
1. Составим химическое уравнение:
х л 37,6 г
C2H4 + Br2 ⟶ C2H4Br2
22,4 л 188 г
Над формулами соединений C2H4 и C2H4Br2 записываем неизвестный объем этилена (х л) и приведенную в условии задачи массу дибромэтана (37,6 г), а под формулами соединений ― массу и объём соответствующего количества вещества согласно коэффициентам в химическом уравнении. При н.у. 1 моль газа при н.у. занимает объем 22,4 л.
Mr(C2H4Br2)=2•Ar(C)+4•Ar(H)+2•Ar(Br)= 2•12+4•1+2•80= 188, поэтому M(C2H4Br2)=1 88 г/моль
2. Объём этилена рассчитываем с помощью пропорции:
х л / 22,4 л = 37,6 г / 188 г, отсюда
х=V( C2H4 )=22,4 л • 37,6 г : 188 г=4,48 л
Ответ: V( C2H4 )=4,48 л
http://fb.ru/article/289442/polimerizatsiya-propilena-shema-uravnenie-formula
http://gdz.cool/h10_edl_2019/1129-h10_e_2019_6.html