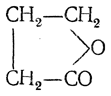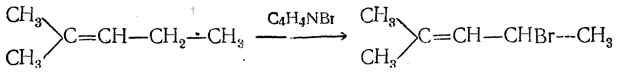Янтарная кислота
| Янтарная кислота | |
|---|---|
 | |
| Хим. формула | C4H6O4 |
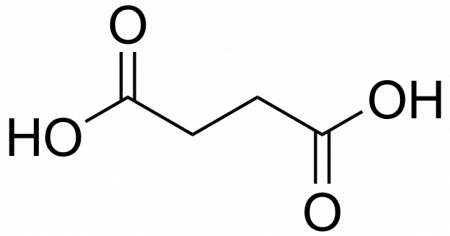
| Рац. формула | HOOC-CH2-CH2-COOH |
| Молярная масса | 118.09 г/моль |
| Температура | |
| • плавления | 183 |
| ГОСТ | ГОСТ 6341-75 |
| Рег. номер CAS | 110-15-6 |
| PubChem | 1110 |
| Рег. номер EINECS | 203-740-4 |
| SMILES | |
| Кодекс Алиментариус | E363 |
| ChEBI | 15741 |
| ChemSpider | 1078 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Янтарная кислота (бутандиовая кислота, этан-1,2-дикарбоновая кислота) — двухосновная предельная карбоновая кислота. Бесцветные кристаллы, растворимые в воде и спирте. Содержится в небольших количествах во многих растениях, янтаре. Стимулирует рост и повышает урожай растений, ускоряет развитие кукурузы. В промышленности янтарную кислоту получают главным образом гидрированием малеинового ангидрида.
Впервые получена в XVII веке перегонкой янтаря. Соли и эфиры янтарной кислоты называются сукцинатами (лат. succinum — янтарь).
Содержание
- 1 Свойства
- 1.1 Органолептические
- 1.2 Физические
- 1.3 Химические
- 2 Биохимическая роль
- 3 Применение
- 3.1 В медицине
Свойства
Органолептические
Янтарная кислота представляет из себя белые кристаллы, обладающие слабокислым и слегка солоновато-горьким привкусом.
Физические
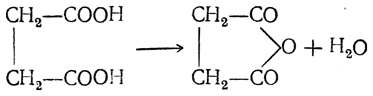
Температура плавления 183 градуса. Выше 235 °C отщепляет H2O и переходит в янтарный ангидрид. Янтарная кислота легко возгоняется при 130—140 °С. Растворимость в воде (граммов в 100 г воды): 6,8 (при 20 °С), 121 (при 100 °С). Также растворяется в этиловом спирте: 9,9 (5 °С); в диэтиловом эфире — 1,2 (при 15 °С). Нерастворима кислота в бензоле, бензине, хлороформе. Константы диссоциации таковы: Ka1 = 7,4*10 −5 , Ka2 = 4,5*10 −6 .
Химические
Метиленовые группы янтарной кислоты обладают высокой реакционной способностью, что связано с влиянием карбоксильных групп. При бромировании янтарная кислота даёт дибромянтарную кислоту HOOC—(CHBr)2—COOH. Диэфиры янтарной кислоты конденсируются с кетонами (конденсация Штоббе) и с альдегидами.
С аммиаком и аминами янтарная кислота образует сукцинимид и его N-замещённые аналоги (R-H, алкильная или арильная группа). Моно- и диамиды янтарной кислоты, получаемые с ароматическими и гетероциклическими аминами, применяют для синтеза некоторых красителей, инсектицидов и лекарственных веществ.
Янтарная кислота и её ангидрид легко вступают в реакцию Фриделя-Крафтса с ароматическими соединениями (так называемое сукцинилирование), образуя производные 4-арил-4-кетомасляной кислоты.
Биохимическая роль
Янтарная кислота участвует в процессе клеточного дыхания кислорододышащих организмов (см. Цикл трикарбоновых кислот).
Летальные дозы (LD50): орально — 2,26 г/кг (крысы), внутривенно — 1,4 г/кг (мыши). ПДК в воде водоёмов 0,01 мг/л
Применение
Янтарная кислота используется в аналитической химии, а также в химическом синтезе для получения пластмасс, смол и лекарственных препаратов.
В пищевой промышленности используется в качестве подкислителя, известна также как пищевая добавка E363.
В медицине
В лекарственных препаратах янтарная кислота применяется в качестве активного вещества как метаболическое средство, улучшающее метаболизм и энергообеспечение тканей, уменьшающее гипоксию тканей.
При воздействии сукцината и гиалуроновой кислоты на клетки кожи достигается омолаживающий эффект редермализации.
Янтарная кислота
Янтарная кислота получена еще в XVII столетии перегонкой янтаря. Она найдена в буром угле, содержится во многих растениях, особенно в недозрелых фруктах. Получается обыкновенно из 1,2-дибромэтана, через цианистый этилен. В небольшом количестве янтарная кислота получается также при спиртовом брожении. Она часто образуется при окислении сложных органических веществ.
или при обработке ее хлорокисью фосфора. Он образует кристаллы с т. пл. 120° С и т. кип. 261° С, растворяется в воде, но на холоду лишь медленно присоединяет воду с образованием янтарной кислоты. При восстановлении янтарный ангидрид образует бутиролактон
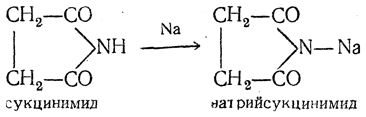
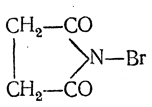
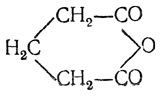
Сукцинимид (имид янтарной кислоты) может быть получен нагреванием янтарной кислоты в токе аммиака при 220° С; кристаллизуется с одной молекулой воды; безводный сукцинимид плавится при 125° С. Под действием натрия он выделяет водород, образуя натрийсукцинимид:
При восстановлении сукцинимида натрием в спиртовом растворе получается пирролидин, а при перегонке его с цинковой пылью образуется пиррол.
При действии брома сукцинимид дает N-бромсукцинимид
являющийся важным средством избирательного бромирования метиленовой группы, соседней с двойной связью (метод Воля— Циглера). Например:
Глутаровая кислота — кристаллы с т. пл. 97,5° С. Перегоняется почти без разложения при 302—304° С. Глутаровая кислота образует ангидрид (тонкие иглы, плавящиеся при 56°С):
Адипиновая кислота образуется при окислении жиров (ее название происходит от латинского adeps — смазка, сало).
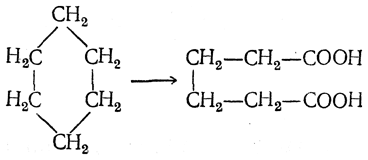
В значительных количествах она может быть получена окислением азотной кислотой циклогексана или соответствующих погонов кавказских нефтей (В. В. Марковников):
Легче окисляются циклогексанол и циклогексанон. Поэтому процесс получения адипиновой кислоты из циклогексана обычно проводится в две стадии. Сначала циклогексан окисляется кислородом воздуха в присутствии катализатора (в технике применяется нафтенат кобальта) до получения смеси циклогекса-нола и циклогексанона, которая затем азотной кислотой окисляется в адипиновую кислоту. В качестве побочных продуктов образуются в довольно значительных количествах низшие дикарбоновые кислоты — янтарная, глутаровая и щавелевая.
В настоящее время адипиновая кислота изготовляется в промышленном масштабе в больших количествах как исходный продукт для получения полиамидных волокон и смол.
Кроме того, адипиновая кислота является полупродуктом в производстве некоторых полиэфиров и полиуретанов для пластических масс и синтетических каучуков. Диэфиры адипиновой кислоты применяются в качестве пластификаторов. В небольших количествах адипиновая кислота применяется в пищевой промышленности взамен лимонной и винной кислот.
Адипиновая кислота образует полимерный ангидрид с т. пл. 95—100° С; в некоторых условиях может образовывать и очень низко плавящийся (22° С) мономерный циклический ангидрид.
Диамид адипиновой кислоты (CH2)4(CONH2)2 (т. пл. 220°С) и динитрил (CH2)4(CN)2 (жидкость с т. кип. 295°С и относительной плотностью d19 19 =0,951) являются промежуточными продуктами при получении 1,6-гексаметилендиамина, служащего для производства полиамидных смол.
Пимелиновая, пробковая (или субериновая) и азелаиновая кислоты получаются наряду с адипиновой кислотой при окислении касторового масла. Пробковая кислота получается также при окислении пробки. Себациновая кислота готовится перегонкой натриевых солей оксикислот, получаемых омылением касторового масла. Диэфиры этих кислот применяются в качестве пластификаторов.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://xumuk.ru/organika/278.html http://acetyl.ru/o/a41k4k.php |