Гидроксид алюминия: получение и свойства
Гидроксид алюминия
Способы получения
1. Гидроксид алюминия можно получить действием раствора аммиака на соли алюминия.
Например , хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония:
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество Na[Al(OH)4] на составные части: NaOH и Al(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Al(OH)3 не реагирует с СО2, то мы записываем справа Al(OH)3 без изменения.
3. Гидроксид алюминия можно получить действием недостатка щелочи на избыток соли алюминия.
Например , хлорид алюминия реагирует с недостатком гидроксида калия с образованием гидроксида алюминия и хлорида калия:
4. Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами . Сульфиды, карбонаты и сульфиты алюминия необратимо гидролизуются в водном растворе.
Например: бромид алюминия реагирует с карбонатом натрия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется бромид натрия:
Хлорид алюминия реагирует с сульфидом натрия с образованием гидроксида алюминия, сероводорода и хлорида натрия:
Химические свойства
1. Гидроксид алюминия реагирует с растворимыми кислотами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
Например , гидроксид алюминия взаимодействует с азотной кислотой с образованием нитрата алюминия:
2. Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
3. Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли . При этом гидроксид алюминия проявляет кислотные свойства.
Например , гидроксид алюминия взаимодействует с гидроксидом калия в расплаве с образованием алюмината калия и воды:
Гидроксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
4. Г идроксид алюминия разлагается при нагревании :
Видеоопыт взаимодействия гидроксида алюминия с соляной кислотой и щелочами (амфотерные свойства гидроксида алюминия) можно посмотреть здесь.
Как из Al получить Al(OH)3? И ещё из АL(OH)3 получить Al2O3?
1 реакция — горение алюминия в кислороде (взаимодействие алюминия с кислородом)
2 реакция — на оксид действуют соляной кислотой, на полученное вещество — щелочью
3 реакция — взаимодействие с соляной кислотой
все легко и просто
2Al + 6Н2О = 2Al(ОН) 3 + 3Н2 — р-ция проводится после снятия оксидной плёнки или с амальгамой.
затем разложить Al(ОН) 3 при нагревании
Гидроксид алюминия
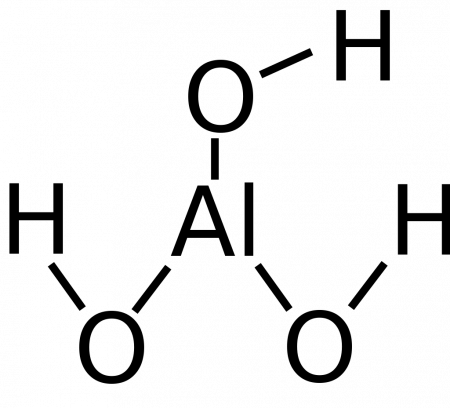
Гидроксид алюминия — вещество с формулой Al(OH)3 (а также H3AlO3) — соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Безопасность
- 4.1 ЛД50
- 5 Применение
Получение
Al(OH)3 получают при взаимодействии солей алюминия с водными растворами щёлочи, избегая их избытка:
AlCl3 + 3 NaOH ⟶ Al(OH)3 ↓ + 3 NaCl
Гидроксид алюминия выпадает в виде белого студенистого осадка.
Второй способ получения гидроксида алюминия — взаимодействие водорастворимых солей алюминия с растворами карбонатов щелочных металлов:
Физические свойства
Гидроксид алюминия представляет собой белое кристаллическое вещество, для которого известны 4 кристаллические модификации:
- моноклинный (γ) гиббсит
- триклинный (γ’) гиббсит (гидрагилит)
- байерит (γ)
- нордстрандит (β)
Существует также аморфный гидроксид алюминия переменного состава Al2O3•nH2O
Химические свойства
Свежеосаждённый гидроксид алюминия может взаимодействовать с:
- кислотами
Al(OH)3 + 3 HCl ⟶ AlCl3 + 3 H2O Al(OH)3 + 3 HNO3 ⟶ Al(NO3)3 + 3 H2O
- щелочами
В концентрированном растворе гидроксида натрия: Al(OH)3 + NaOH ⟶ Na[Al(OH)4] При сплавлении твёрдых реагентов: Al(OH)3 + NaOH → 1000oC NaAlO2 + 2 H2O
При нагревании разлагается:
С растворами аммиака не реагирует.
Безопасность
>5000 мг/кг (крысы, перорально).
Применение
Гидроксид алюминия используется при очистке воды, так как обладает способностью адсорбировать различные вещества.
В медицине, в качестве антацидного средства, в качестве адъюванта при изготовлении вакцин.
В качестве абразивного компонента зубной пасты.
В качестве антипирена (подавителя горения) в пластиках и других материалах.
После обработки до окислов применяется в качестве носителя для катализаторов.
http://sprashivalka.com/tqa/q/5428946
http://chem.ru/gidroksid-aljuminija.html