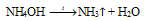Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e1d6c78ab1a1ea1 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Получение аммиака и изучение его физических и химических свойств
Получение аммиака.
Проведем все действия, описанные в учебнике. Из газоотводной трубки будет выделяться аммиак. Он растворяется в воде, пропитавшей фенолфталеиновую бумажку. Уравнение реакции имеет вид:
В результате образуется гидроксид аммония, который имеет щелочную реакцию окрашивает индикатор в малиновый цвет.
Изучение свойств аммиака
Если поднести к отверстию пробки стеклянную палочку, смоченную концентрированной соляной кислотой, то над отверстием образуется белая дымка. Происходит реакция:
NH4Cl обладает летучестью, его частички поднимаются вместе с аммиаком. Их мы и видим в виде белой дымки. Проведем растворение аммиака так как это описало в учебнике. Из-за очень хорошей растворимости аммиака вода в пробирке поднимается. Образуется NH4OH.
1. Запишем уравнение реакции между Са(ОН)2 и NH4Cl:
Как можно видеть из уравнения, в реакции образуются пары воды. Они конденсируются на более холодных стенках пробирки. Если капельки воды попадут на раскалённое дно, то пробирка может треснуть. Поэтому ее наклоняют таким образом, чтобы капельки скатывались к отверстию пробирки.
2. Аммиак легче воздуха (т.к. М(NH3) = 17 г/моль.
М(воздуха) = 29 г/моль). Он поднимается вверх, поэтому его надо собирать в перевернутую пробирку. Аналогично можно собирать Н2 (М = 2 г/моль), СН4 — метан (М= 16 г/моль); Не (М= 4г/моль) и другие.
З. Если вместо НСl поднести к отверстию пробирки с аммиаком палочку, смоченную концентрированной азотной кислотой, то мы ничего не увидим:
NH4NO3 — не обладает летучестью.
4. Обычно для определения оснований используют реакции с образованием нерастворимых гидроксидов, например, Mg(OH)2. Уравнение реакции имеет вид:
Выпадает белый осадок.
Изучение свойств водного раствора аммиака.
1. Водный раствор аммиака имеет щелочную среду, т.е. дает малиновую окраску с фенолфталеином. При кипячении раствора гидроксид аммония разлагается, в результате чего аммиак улетучивается, а раствор становится нейтральным.
Фенолфталеин в нейтральной среде — бесцветный.
2. Фенолфталеин дает малиновую окраску в растворе гидроксида аммония, так как тот является основанием. При добавлении соляной кислоты происходит нейтрализация раствора и цвет исчезает.
3. Происходит взаимодействие между раствором АlCl3 и NH4OH.
Практическая работа » Получение аммиака и изучение его свойств»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
ПЛАН ПРОВЕДЕНИЯ УРОКА ХИМИИ
Практическая работа № 7.
Получение аммиака и изучение его свойств.
Цель: 1. овладеть одним из способов получения аммиака реакцией ионного
обмена, которая используется и как качественная реакция на соли
2. совершенствовать умения собирать прибор для получения газа легче
3. изучить свойства водного раствора аммиака;
4. закреплять умение наблюдать за явлениями, описывать их и делать
Оборудование: прибор для получения аммиака, NH 4 CI , Ca ( OH ) 2 , H 2 O , c теклянные палочки, чашки Петри, фенолфталеин, нагревательный прибор, штатив.
I Постановка целей и задач урока.
На уроке мы должны получить аммиак реакцией ионного обмена и изучить свойства этого газа и его водного раствора – гидроксида аммония.
II . Повторение правил техника безопасности
1.Экономное расходование веществ.
2.При выяснении запаха веществ не подносите сосуд близко к лицу, иначе вдыхание паров и газов может вызвать раздражение дыхательных путей.
3.Проводите опыты только над столом, нагревая пробирку с жидкостью, держите её так, чтобы открытый конец её был направлен в сторону и от самого себя и от соседей.
4.Не приступайте к выполнению опыта, не зная, что и как нужно делать.
На лист бумаги или в небольшую фарфоровую чашку (можно ступку) насыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке (ложечка для сжигания веществ).
Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте ее пробкой с газоотводной трубкой и укрепите в лапке штатива.
При укреплении прибора в лапке штатива обратите внимание на наклон пробирки относительно ее отверстия. На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
Пробирку со смесью хлорида аммония и гидроксида кальция прогрейте сначала всю (2—3 движения пламени), а затем нагрейте в том месте, где находится смесь.
Почему пробирка вверх дном? ( NH 3 легче воздуха в 2 раз).
Как вы узнаете, что получили NH 3 ?
1)по запаху (резкий запах);
2)поднесите к отверстию перевёрнутой вверх дном пробирки влажную фенолфталеиновую бумажку(она стала малиновой).
2)Не переворачивая пробирку, быстро опустите её в чашку с водой отверствием вниз, подержите так, капните фенолфталеин. Что произошло? Какое вещество мы получили?
Аммиак очень хорошо растворим в воде!
3)Получение „дыма без огня”
В результате этих реакций мы получили какие вещества? (соли аммония).
получили аммиак, обнаружили по резкому запаху, имеет основной
характер, хорошо растворим в воде, образуя основание, аммиачную
воду, взаимодействует с кислотами, образуя соли.
2.Изучение свойств водного раствора аммиака.
1 . NH 4 OH + 2,3 капли фенолфталеина → малиновая окраска
NH 4 OH + 2,3 капли фенолфталеина → малиновая окраска, + HCI
Как изменился цвет? Почему?


Н + + ОН — = Н 2 О реакция нейтрализации
AI 3+ + 3OH — = AI (OH) 3 ↓
при изучении свойств водного раствора NH 3 выяснили, что это
основание, разлагается при нагревании, взаимодействует
с кислотами и солями.
IV Подведение итога урока.
Вывод по уроку: чему научились?
Получили аммиак, изучили его свойства, а также свойства нашатырного спирта.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 939 человек из 80 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 23 человека из 14 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 40 человек из 24 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 587 500 материалов в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
«Психологические методы развития навыков эффективного общения и чтения на английском языке у младших школьников»
Свидетельство и скидка на обучение каждому участнику
Другие материалы
- 01.06.2017
- 680
- 5
- 01.06.2017
- 411
- 0
- 01.06.2017
- 849
- 0
- 01.06.2017
- 6436
- 13
- 31.05.2017
- 2017
- 4
- 31.05.2017
- 677
- 0
- 31.05.2017
- 1807
- 1
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 01.06.2017 107038
- DOCX 48 кбайт
- 1319 скачиваний
- Рейтинг: 3 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Бережная Елена Витальевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 5 лет и 2 месяца
- Подписчики: 0
- Всего просмотров: 107509
- Всего материалов: 2
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
В Швеции запретят использовать мобильные телефоны на уроках
Время чтения: 1 минута
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
Ленобласть распределит в школы прибывающих из Донбасса детей
Время чтения: 1 минута
В ростовских школах рассматривают гибридный формат обучения с учетом эвакуированных
Время чтения: 1 минута
Приемная кампания в вузах начнется 20 июня
Время чтения: 1 минута
Рособрнадзор не планирует переносить досрочный период ЕГЭ
Время чтения: 0 минут
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Только 23 февраля!
Получите новую
специальность
по низкой цене
Цена от 1220 740 руб. Промокод на скидку Промокод скопирован в буфер обмена ПП2302 Выбрать курс Все курсы профессиональной переподготовки
http://buzani.ru/khimiya/o-s-gabrielyan-9kl/593-prakticheskaya-rabota-7-poluchenie-ammiaka-i-izuchenie-ego-svojstv
http://infourok.ru/prakticheskaya-rabota-poluchenie-ammiaka-i-izuchenie-ego-svoystv-1943574.html