Сложные эфиры салициловой кислоты
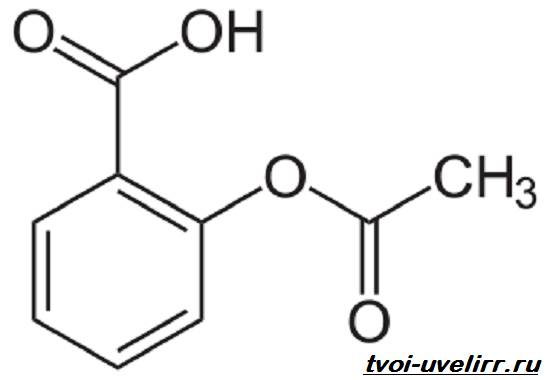
Из группы лекарственных веществ, производных сложных эфиров салициловой кислоты, будет рассмотрена кислота ацетилсалициловая, представляющая собой сложный эфир салициловой и уксусной кислот.
Промышленный способ получения кислоты ацетилсалициловой основан на нагревании смеси салициловой кислоты, уксусного ангидрида и концентрированной серной кислоты:
Кислота ацетилсалициловая (табл. 35.1) — кристаллическое вещество. Она мало растворима в воде, но легко растворима в растворах гидроксидов щелочных металлов, этаноле, хлороформе.
35.1. Свойства кислоты ацетилсалициловой
| Лекарственное вещество | Химическая структура | Описание |
| Acetylsalicylic acid— кислота ацетилсалициловая |  салициловый эфир уксусной кислоты салициловый эфир уксусной кислоты | Бесцветные кристаллы или белый кристаллический порошок без запаха или со слабым запахом. Т. пл. 133–138°C |
Подлинность кислоты ацетилсалициловой подтверждают по ИК-спектру в области 4000-400 см –1 (в дисках с бромидом калия). Он должен полностью совпадать с полосами поглощения прилагаемого к ФС спектра. УФ-спектр 0,007%-ного раствора кислоты ацетилсалициловой в хлороформе имеет в области 260-350 нм максимум поглощения при 278 нм, а УФ-спектр 0,001%-ного раствора в 0,1 М растворе серной кислоты в области 220-350 нм — два максимума при 228 и 276 нм и один минимум поглощения при 257 нм.
Для испытания подлинности используют реакцию гидролиза в кислой или щелочной среде с последующей идентификацией продуктов гидролиза. Кислоту ацетилсалициловую подвергают гидролизу в щелочной среде:
Затем подкисляют разведенной серной кислотой и наблюдают образование белого кристаллического осадка салициловой кислоты:
К фильтрату, содержащему уксусную кислоту, прибавляют этанол и концентрированную серную кислоту — образуется уксусноэтиловый эфир, имеющий характерный запах:
Салициловую кислоту, содержащуюся в осадке, растворяют в этаноле и идентифицируют с помощью хлорида железа (III) по образованию фиолетового окрашивания.
Кислоту ацетилсалициловую можно подвергнуть и кислотному гидролизу. При добавлении концентрированной серной кислоты и воды ощущается запах уксусной кислоты. Если затем добавить раствор формальдегида, то появляется розовое окрашивание (цветная реакция на салициловую кислоту).
Кислота ацетилсалициловая при взаимодействии с 2%-ными растворами 4-аминоантипирина и гексацианоферрата (III) калия приобретают желтое окрашивание (хлороформное извлечение).
При испытании на чистоту устанавливают содержание примеси свободной салициловой кислоты (не более 0,05%) фотоколориметрическим методом, с использованием в качестве реактива железоаммониевых квасцов, измеряя светопоглощение при длине волны 520 нм. Расчёты выполняют по РСО кислоты салициловой. Обнаруживают также органические примеси и вещества, нерастворимые в растворе карбоната натрия.
Кислоту ацетилсалициловую количественно можно определить цериметрическим методом, основанным на окислении сульфатом церия (IV) до образования глутаровой, муравьиной и других алифатических кислот. Химизм и методика определения сходна с цериметрическим определением резорцина (см. ч. 2, гл. 31).
Для количественного определения кислоты ацетилсалициловой может быть использована реакция щелочного гидролиза. Для этого берут избыток 0,5 М раствора гидроксида натрия (не содержащего карбонатов) и гидролизуют при нагревании на кипящей водяной бане с обратным холодильником (химизм указан при описании испытания на подлинность). Избыток титрованного раствора гидроксида натрия оттитровывают 0,5 М раствором хлороводородной кислоты.
Для определения кислоты ацетилсалициловой ФС рекомендован способ, основанный на её нейтрализации без предварительного гидролиза:
Кислоту ацетилсалициловую растворяют в нейтрализованном и охлажденном до 8–10 °C этаноле и титруют 0,1 М раствором гидроксида натрия (индикатор фенолфталеин).
В результате исследования УФ-спектров поглощения растворов кислоты ацетилсалициловой и других сложных эфиров салициловой кислоты в различных растворителях (вода, этанол, хлороформ, дихлорэтан, 0,1 М раствор гидроксида натрия) разработаны методики их спектрофотометрического определения непосредственным и дифференциальным методами (С.Г. Тираспольская).
Описан УФ-спектрофотометрический способ определения кислоты ацетилсалициловой, основанный на предварительном ее гидролизе в щелочной среде до салицилата натрия в присутствии пероксида водорода. Последний ускоряет процесс гидролиза, окончание которого наступает через 15 мин. Затем измеряют оптическую плотность раствора на спектрофотометре в максимуме поглощения (290 нм).
Кислоту ацетилсалициловую хранят в сухом месте, в хорошо укупоренной таре. Она устойчива в сухом воздухе, во влажном — постепенно гидролизуется с образованием кислот уксусной и салициловой.
Кислоту ацетилсалициловую применяют внутрь в качестве противоревматического, противовоспалительного, болеутоляющего и жаропонижающего средства по 0,25–0,5 г 3–4 раза в день. Исследования последних лет показали, что кислота ацетилсалициловая в малых дозах оказывает также антитромботическое действие, так как угнетает агрегацию тромбоцитов.
Кислоту ацетилсалициловую называют лекарством XX века. Считают, что указанным её «лечебный потенциал» не исчерпан. Однако она не лишена побочных явлений, т.к. раздражает слизистую оболочку желудка, может вызвать кровотечение, аллергические реакции и др.
Ацетилсалициловая кислота. Свойства, получение, применение и польза ацетилсалициловой кислоты
Лекарство по половому признаку. Пару лет назад ученые взялись исследовать уже проведенные исследования. Взяли 23 теста, касающихся ацетилсалициловой кислоты . В народе она известна как «Аспирин».
В исследованиях участвовали 113 000 человек. Ученые взялись выяснить, зависимость результатов тестов от соотношения мужчин и женщин в группах испытуемых.
Выяснилось, что результативность действия кислоты была выше в мужских коллективах. Почему? Пока, это загадка. Поговорим о том, в чем ацетилсалициловая кислота понятна. Начнем с изученных свойств вещества.
Свойства ацетилсалициловой кислоты
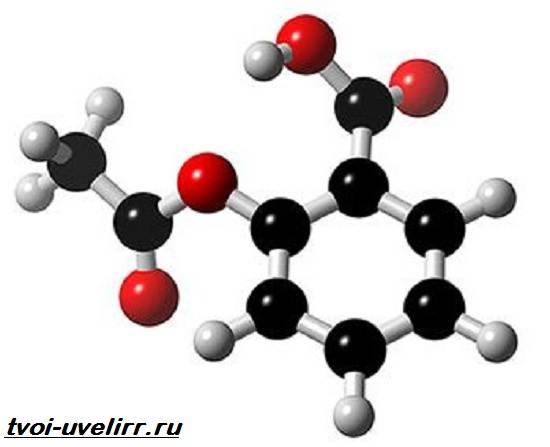
Формула ацетилсалициловой кислоты – С9Н8О4. Второе название вещества – 2-гидроксибензойное. Приставка «гидрокси» дана за присутствие гидроксила ОН. Бензойная кислота , к коей он присоединен, является простейшей в классе карбоновых кислот .
Структурная формула ацетилсалициловой кислоты
В них есть карбоксильные группы COOH. В бензойной, как и ацетилсалициловой кислоте , она всего одна. Это обязательное условие не только для простых, но и жирных кислот . Для последних есть еще одно условие – открытая цепь.
Именно такая у героини статьи. В этерифицированной форме, то есть виде эфира, жирные кислоты присутствуют в жирах. Ацетилсалициловое соединение – не исключение.
Зная, что ацетилсалициловая кислота это «Аспирин» легко догадаться, какова она внешне. Вещество кристаллическое, бесцветное. Известно и то, что соединение диссоциирует в воде. Легко растворяется героиня статьи и в этаноле, диэфире.
Идентифицируют героиню статьи, так же, по температуре плавления. Она составляет 156 градусов. Закипает вещество при 211-ти по шкале Цельсия. Реакция определения ацетилсалициловой кислоты проходит в ее растворе. Если добавить хлорид железа , жидкость окрашивается в фиолетовый .
Героиня статьи может выпадать из растворов в осадок. Это происходит при закислении среды. Именно в этот момент удобно определять соединение по температуре плавления, ведь для опыта нужна кристаллическая кислота .
Кстати, форма кристаллов – тоже идентификатор ацетилсалициловой кислоты . Ее агрегаты моноклинные, то есть строятся на 3-ех векторах. У них разная длина. Меж векторами 2 прямых угла и один нет.
Кристаллы кислоты стабильны лишь в сухом воздухе. Во влажной среде порошок вбирает воду. При этом, образуется две кислоты – уксусная и салициловая. У первой знакомый запах.
При его появлении можно понять, что героиня статьи начала распадаться. Химики именуют процесс гидролизацией. Сама ацетилсалициловая кислота почти не пахнет.
Ацетилсалициловое соединение поддается этерификации. Так химики именуют образование сложных эфиров. Для их формирования на кислоту воздействуют щелочными бикарбонатами и гидроксидами.
Запускается реакция в кипящей воде. Кстати, растворимость в ней аспирина зависит от Ph жидкости. Лучше всего героиня статьи распадается в воде с щелочной средой.
Получение ацетилсалициловой кислоты
«Аспирин» получают карбоксилированием фенолята натрия . Он берется сухим. Воздействуют на фенолят углекислым газом . Метод именуется «Кольбе-Шмитта». Нужно выдержать давление в 0,6 мегапаскалей и температуру в 185 градусов Цельсия. В этих условиях реакция протекает от 8-ми до 10-ти часов .
Химическая формула ацетилсалициловой кислоты
Альтернативным методом промышленного синтеза героини статьи является окисление о-крезола, то есть неочищенной карболовой кислоты . Воздействуют на нее окисью меди . Реакция проходит при нагреве. Порой, окисляют предварительно сульфированный крезол. В этом случае увеличивается выход ацетилсалициловой кислоты .
Применение ацетилсалициловой кислоты
«И аспирина тягостный глоток дарит тебе непринужденность духа, благие преимущества недуга и смелости недобрый холодок». Эти строки из стихотворения Беллы Ахмадулиной.
Поэтесса Серебряного века включила их во «Вступление в простуду». Делаем вывод: в фармакологии ацетилсалициловая кислота применяется около века и значима с самого старта.
Доказано, что «Аспирин» блокирует выработку простагландинов. Это липиды. Они формируются в организме ферментативно из жирных кислот . Простагландины снижают артериальное давление.
Второе действие – стимуляция сокращений миометрия. Это слой клеток, выстилающих матку. Делаем вывод, от чего помогает ацетилсалициловая кислота, — от преждевременной родовой деятельности.
Ацетилсалициловая кислота применяется при простуде и головных болях
Акушеры-гинекологи прописывают по четвертинке «Аспирина» женщинам с угрозой выкидыша, гиппертонусом матки. Но, широким массам ацетилсалициловая кислота известна, как жаропонижающее средство.
В этом качестве препарат разрешен с 12-летнего возраста. У подростков и взрослых лекарство не только снижает температуру, но и купирует боли. Соответственно, ацетилсалициловая кислота инструкцию по применению содержит, рекомендующую средство при спазмах менструального плана, головных, ноющих ощущениях в полости рта.
Боли в мышцах и суставах «Аспирин» тоже гасит. Заметим, что «Аспирин» выпускается в нескольких формах. Их действие разниться. Шипучие таблетки, к примеру, применяются исключительно при мигренях и прочих болях в голове .
Рекомендована ацетилсалициловая кислота и при ряде раковых заболеваний, а так же, в роли их профилактики. У пациентов регулярно принимающих аспирин реже диагностируют злокачественные опухоли мочевого пузыря, предстательной железы, пищевода.
В противораковые средства «Аспирин» не включают. Пока, врачи не могут объяснить механизм действия препарата, не исключают случайный фактор в статистике.
В начале статьи говорилось об еще одном не объясненном учеными явлении. Речь о разной эффективности ацетилсалициловой кислоты в отношении организмов мужчин и женщин. Из правила есть исключение.
Болезнь Альцгеймера героиня статьи блокирует, в основном, у представительниц слабого пола. По идее, действие препарата должно быть одинаковым для всех. «Аспирин» разжижает кровь .
Соответственно, улучшается затрудненное кровоснабжение мозга. Это главное подспорье в борьбе с недугом, забирающим память. Почему на больных Альцгеймером мужчин метод не работает, остается загадкой.
Вне фармакологии ацетилсалициловая кислота находит применение в быту и аграрном деле. Из уст в уста передается рекомендация растворять таблетку «Аспирина» в вазе со срезанными цветами.
В лекарственном растворе, как и в воде с марганцовкой, растения дольше сохраняют свежесть. На полях же кислота применяется в борьбе с грибковыми поражениями почвы. Проблемные грядки проливают раствором «Аспирина» из расчета одна таблетка на литр воды.
Автомобилисты использую героиню статьи, заводя машины. Таблетки «Аспирина» помогают при севших аккумуляторах. Идет реакция лекарства с электролитом, дающая кратковременный заряд.
Метод актуален для неожиданно севшего прибора. Обычно, он дает сбои в морозы. Как постоянное средство для завода аккумулятора «Аспирин», конечно, не годится.
Хозяйки знают героиню статьи, как средство для выведения пятен от пота. На одежде они остаются белесыми разводами. Вывести их помогает 2-часовое замачивание в растворе ацетилсалициловой кислоты. Цена пятновыводителя из магазина в разы дороже. На стакан воды берут 4 таблетки «Аспирина».
Противовоспалительное действие «Аспирина» сделало его борцом с акне. Ацетилсалициловая кислота от прыщей используется в виде пасты. Таблетки толкут и смешивают с водой.
Пасту точечно наносят на воспаления. Препарат подсушивает очаги, снимает покраснение. Достаточно 2-3-ех минут. После, мазь смывают теплой, мыльной водой.
Ацетилсалициловая кислота для лица может выступать и отшелушивающим агентом. Правда, учитывая нежность кожи на лбу, щеках, вблизи глаз, героиню статьи чаще используют для пяток.
Ацетилсалициловая кислота от прыщей
Там разъедающее действие кислоты к месту, борется с натоптышами. Истолченные таблетки «Аспирина» смешивают с соком лимона . На чайную ложку берут 5 таблеток. Понадобится, так же, пара капель воды.
Смесь мажут на огрубевшие области, заматывают тканевыми салфетками. После, ступни обматывают полиэтиленом. Снимают его через 10-15 минут. Остается пройтись по стопам пемзой. Она легко снимет размягченные ткани.
Ацетилсалициловая кислота детям и взрослым пригождается при укусах пчел. Места проколов кожи смачивают чистой водой и натирают таблеткой «Аспирина». Натирать героем статьи можно и волосы.
Средство полезно для окрашенных, контактировавших с хлоркой. Типичная ситуация для тех, кто ходит в бассейн. На стакан воды разводят 6 таблеток «Аспирина», протирают локоны, а через 15 минут смывают с шампунем.
Окрашенные волосы не теряют цвет, о пористости нет и речи. Так что, ацетилсалициловая кислота от температуры – лишь вершина айсберга ее применения.
Польза и вред ацетилсалициловой кислоты
Можно ли ацетилсалициловую кислоту принимать без рецепта врача? Внутрь нельзя, а наружно не желательно. «Аспирин», все же, кислота. Оказывая разъедающее действие на кожу, вещество поступает так же и со слизистыми. Соответственно, длительный прием ацетилсалицилового соединения внутрь способен привести к гастриту и язве желудка.
Раздражающее действие героини статьи на желудок называется ацедозом. Рекомендован контроль гастроэнтеролога. Могут возникнуть внутренние кровотечения.
Минимизировать риски при необходимости постоянного приема «Аспирина» поможет соблюдение инструкции. Таблетки запиваются небольшим количеством воды и, главное, принимаются во время еды.
Детям до 12-ти лет ацетилсалициловая кислота противопоказана из-за риска возникновения синдрома Рейе. Его еще именуют белой печеночной болезнью. Недуг редкий, но смертельно опасный, возникает именно у детей и подростков.
Синдром развивается на фоне лечения лихорадочных недугов типа ОРВ, кори или ветряной оспы. Поражается не только печень, но и мозг. Причем, Рейе возникает исключительно параллельно лечению «Аспирином».
Передозировка ацетилсалициловой кислотой у взрослых, порой, приводит к глухоте, кожным высыпаниям, длительным кровотечениям при ранениях. Собственно, нарушения кровообращения – не только итог употребления героини статьи, но и противопоказание к ее применению, как и гипертония, астма, хронические заболевания печени.
В США, к примеру, опубликованы данные о ежегодной смерти почти 17 000 жителей страны, обусловленной бесконтрольным приемом «Аспирина». Так что, абсолютная безвредность ацетилсалицилового препарата – миф.
Впрочем, в неконтролируемых дозах все может быть смертельно. В газете «ЗОЖ», к примеру, описан случай смерти мужчины, ежедневно выпивавшего 2 литра морковного сока. То, что считается эликсиром здоровья , стало причиной смерти лишь из-за объемов выпитого и постоянства приема сока .
Ацетилсалициловая кислота (аспирин)
В небольшую коническую колбу помещают 2 г предварительно высушенной при 100 °С салициловой кислоты и 2,8 мл уксусного ангидрида. Добавляют 2 – 3 капли концентрированной серной кислоты и хорошо перемешивают содержимое колбы. Не прекращая размешивания, нагревают смесь на водяной бане при 60 °С в течение 15 мин, а затем дают ей охладиться до комнатной температуры.
Добавляют в колбу 30 мл воды, хорошо перемешивают и отфильтровывают осадок на воронке Бюхнера. Неочищенную ацетилсалициловую кислоту перекристаллизовывают из смеси равных объемов уксусной кислоты и воды, отфильтровывают, промывают на фильтре ледяной водой и затем толуолом. Полученный таким образом аспирин сушат при 40 – 60 °С до исчезновения запаха уксусной кислоты. Выход 95 %. Тпл 144 °С
Пояснения к синтезу
Ацилированию, т.е. замещению подвижных атомов водорода на остатки кислот – ацилы – могут подвергаться амины, фенолы, спирты и другие соединения. При синтезе аспирина водород фенольного гидроксила в салициловой кислоте замещается на остаток уксусной кислоты – ацетил (СН3СО-). Механизм реакции может быть представлен следующим образом:
уксусный ангидрид I:протонированый уксусный ангидрид
Это пример нуклеофильного замещения у карбонильного атома углерода в уксусном ангидриде. Из-за электроноакцепторного влияния орто-карбоксильной группы в салициловой кислоте основные (и нуклеофильные) свойства фенольного гидроксила ослаблены. Это вызывает необходимость добавлять в смесь кислотный катализатор (конц. Н2SО4). Сам фенол ацилируется уксусным ангидридом в отсутствии кислоты. Протонирование карбонильного кислорода приводит к катиону I, в котором электрофильность углерода сильно повышена. Это облегчает нуклеофильную атаку и образование промежуточного соединения II, в котором карбонильный углерод переходит из sр 2 — в sр 3 — состояние.
При перекристаллизации продукта из разбавленной уксусной кислоты не следует кипятить раствор дольше, чем требуется для растворения ацетилсалициловой кислоты во избежание ее гидролитического разложения. Перекристаллизованный продукт отфильтровывают и осадок промывают сначала небольшим количеством ледяной воды, а затем холодным толуолом.
Чистая ацетилсалициловая кислота имеет температуру плавления 144 °С. Однако при нагревании она разлагается, поэтому ее истинную температуру плавления определить трудно. Обычно получается препарат, плавящийся в интервале 129 – 133 °С.
Контрольные вопросы
1. Почему при взаимодействии салициловой кислоты и уксусного ангидрида в качестве нуклеофильного центра выступает кислород фенольной, а не карбоксильной группы ОН?
2. Почему салициловая кислота ацилируется труднее фенола?
3. Объясните, почему серная кислота ускоряет реакцию ацилирования салициловой кислоты?
4. Напишите реакцию гидролиза аспирина. Как эта реакция может влиять на результат определения температуры плавления полученного препарата? Что следует предпринять для того, чтобы температура плавления препарата была как можно ближе к истинной температуре плавления ацетилсалициловой кислоты (135 °С)?
5. Напишите схему механизма гидролиза ацетилсалициловой кислоты, проходящего в кислой среде. Будет ли аспирин гидролизоваться в щелочной среде?
6. С помощью какой цветной реакции можно обнаружить примесь салициловой кислоты в долго хранившемся аспирине? Для ответа на этот вопрос необходимо прочитать в учебнике о цветных реакциях фенолов [1].
7. Какие предосторожности нужно соблюдать при синтезе ацетилсалициловой кислоты?
2.1.6. н-Бутилацетат
В круглодонную колбу емкостью 100 мл, снабженную ловушкой для отделения воды и обратным холодильником (рис. 14), помещают 10 мл ледяной уксусной кислоты, 12 мл н-бутилового спирта, 5 капель конц. серной кислоты и несколько небольших осколков фарфора, которые будут служить в качестве “кипелок”. Нагревают колбу на песчаной бане. Жидкость должна кипеть достаточно интенсивно, однако, обратный холодильник не должен “захлебываться”.
Вода, образующаяся по реакции, улетает из реакционной колбы вместе с парами спирта и сложного эфира. Смесь паров конденсируется в обратном холодильнике, конденсат попадает из него в ловушку и в ней расслаивается. Верхний органический слой, в котором содержатся образовавшийся сложный эфир и бутиловый спирт, возвращается (перетекает) в колбу, а нижний слой воды постепенной увеличивается.
| После того, как количество воды в ловушке перестанет увеличиваться, колбе дают охладиться и реакционную смесь вместе с содержимым ловушки переносят в делительную воронку. Нижний слой отделяют, а верхний промывают вначале водой, затем 5 % раствором соды и вновь водой. Сложные эфиры при энергичном встряхивании с промывными жидкостями дают стойкие эмульсии; во избежание этого делительную воронку целесообразно не встряхивать, а совершать ею движение, подобное “восьмерке”. Отмытый бутилацетат обезвоживают прокаленным сульфатом натрия не менее 6 час, затем подвергают дробной перегонке, собирая фракцию 124 – 126 °С. Выход 80 %. Ткип 126 °С По этой методике могут быть получены: из изобутилового спирта – изобутилацетат, Ткип 118 °С, из изоамилового спирта – изоамилацетат, Ткип 142 °С. |  Рис. 14. Установка для проведения реакций с азеотропной отгонкой воды: 1 – реакционная колба, 2 – ловушка для отделения воды, 3 – обратный холодильник, 4 – воздушная или песчаная баня Рис. 14. Установка для проведения реакций с азеотропной отгонкой воды: 1 – реакционная колба, 2 – ловушка для отделения воды, 3 – обратный холодильник, 4 – воздушная или песчаная баня |
Пояснения к синтезу
Реакция этерификации – обратимый процесс, поэтому для того, чтобы добиться более полного превращения карбоновой кислоты в сложный эфир, из реакционной смеси удаляют образующуюся воду. Для этого используют способность воды отгоняться из реакционной массы в виде азеотропной смеси со спиртом и сложным эфиром.
Азеотропная смесь веществ кипит и перегоняется как одно индивидуальное соединение с определенной температурой кипения; ее невозможно разделить путем перегонки. Примером азеотропной смеси является 96 % этиловый спирт. Этот азеотроп имеет температуру кипения 78,17 °С в отличие от Ткип чистого этанола 78,3° С. Для получения 100 % (“абсолютного”) этилового спирта приходится применять специальные методы: химически связывать воду с помощью безводных солей (СuSО4), оксида кальция, металлического магния. Можно также отгонять воду в виде тройного азеотропа бензол-этанол-вода, добавляя к 96 % этанолу бензол с последующей перегонкой.
Азеотропные смеси могут иметь меньшие или большие температуры кипения по сравнению с Ткип составляющих их компонентов. Для отделения воды используют смеси с минимальными температурами кипения. Не всякая пара летучих веществ образует азеотропную смесь. Например, уксусная кислота не образует азеотропа с водой. В тех случаях, когда ни реагенты, ни продукт реакции не образует азеотропных смесей с водой или когда в азеотропе соотношение вода-органическое соединение слишком мало (как, например, в случае этилового спирта), в реакционную массу добавляют растворитель, способный образовывать азеотропную смесь с водой. Так, при получении по вышеописанной методике этил- или пропилацетата в колбу вносят 35 – 40 мл хлороформа или четыреххлористого углерода.
Азеотропная смесь вода-бутиловый спирт перегоняется при 92,7 °С (сравните с температурами кипения н-бутанола, воды и уксусной кислоты). Она содержит 42,5 % Н2О и 57,5 % спирта. Азеотроп вода-н-бутилацетат, содержащий 28,7 % Н2О и 71,3 % сложного эфира, кипит при 90,2 °С. В присутствии всех трех компонентов перегоняется и тройная азеотропная смесь вода-бутанол-бутилацетат.
2.2. ЭЛЕКТРОФИЛЬНОЕ ЗАМЕЩЕНИЕ
В АРОМАТИЧЕСКОМ РЯДУ
http://tvoi-uvelirr.ru/acetilsalicilovaya-kislota-svojstva-poluchenie-primenenie-i-polza-acetilsalicilovoj-kisloty/
http://megaobuchalka.ru/4/41521.html