Соли аммония: получение и химические свойства
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Хлорид аммония
наименование
Хлорид аммония (хлористый аммоний; техническое название — нашатырь; NH4Cl) — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Применение
Физические свойства
Бесцветные или белые кубические кристаллы. Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Химические свойства
- реагирует с щелочами с выделением аммиака:
NH4Cl + NaOH → NaCl + H2O + NH3↑
- реагирует с нитратом серебра с выпадением белого осадка хлорида серебра, темнеющего при действии света:
NH4Cl + AgNO3 → AgCl↓ + NH4NO3
- реагирует с нитритом натрия при нагревании, с образованием хлорида натрия, азота и воды:
NH4Cl + NaNO2 → NaCl + N2↑ + 2H2O
- под действием электрического тока разлагается с образованием хлористого азота NCl3
Получение
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NaCl.
Иногда используют реакцию взаимодействия аммиака с хлором:
Реакция взаимодействия аммиака и соляной кислоты:
Хлорид аммония (нашатырь, Е510): описание, реакции, применение
Хлорид аммония – это неорганическое азотсодержащее вещество, имеющее минеральную природу. Нашатырь, как часто называют хлорид аммония, обладает высокой химической активностью, поэтому используется во многих сферах. В пищевой промышленности хлористому аммонию присвоен статус пищевой добавки Е510, но применение ограничено в связи с неприятным вкусом и запахом. Может вноситься в почву в качестве удобрения, содержащего азот и хлор. Также его применяют в медицине, металлургии и фотографии. Вещество обладает отхаркивающими, мочегонными свойствами, назначается для откашливания мокроты при заболеваниях дыхательных путей, а также в качестве натурального диуретика.
Что такое хлорид аммония, формула
Хлорид аммония – это собой среднюю хлористую соль аммония с химической формулой NH4Cl. В нормальных условиях хлористый аммоний имеет вид белого или желтоватого крупнодисперсного порошка, состоящего из кристаллов прямоугольной формы. Гигроскопичность слабая, не имеет запаха.
Вещество переходит из твёрдого состояния в газообразное при температуре 337,6 °С, в жидком состоянии кипит при очень высокой температуре (520°С). Хорошо растворим в органических растворителях, особенно в спиртах: в метаноле больше, чем в этаноле. Растворяется в воде и жидком аммиаке, при повышении температурного режима растворимость медленно возрастает, наибольшая наблюдается при 100°С.
Насыщенные водные растворы нашатыря имеют меньшую точку кипения (116 °С), проявляют слабокислую реакцию в результате сольволиза водой, поскольку происходит отделение большого количество протонов водорода (H + ).
В природе хлорид аммония встречается в виде минерала нашатыря, имеющего сходную химическую формулу, но с примесями железа (Fe), йода (I) и брома (Br). Обладает жёсткой кубической кристаллической решеткой. Кристалл белого, желтоватого, сероватого или коричневатого цвета, со стеклянным блеском, обладает низкой хрупкостью, режущийся, минимальной твёрдости по шкале Мооса. При раскалывании нашатырь образует раковистый излом.
Минерал формируется в естественных условиях в результате вулканической активности или в районе горячих источников. Имеет вид налётов, корочек, редко образуя массивные скопления. Чаще всего его находят в залежах разложившегося помёта верблюдов, летучих мышей, морских птиц. Нашатырь имеет неприятный резкий горько-солёный вкус, достаточно токсичен, запах едкий, отрезвляющий, в прошлом использовался как компонент нюхательной соли: водным раствором минерала пропитывали углеаммонивые соли.
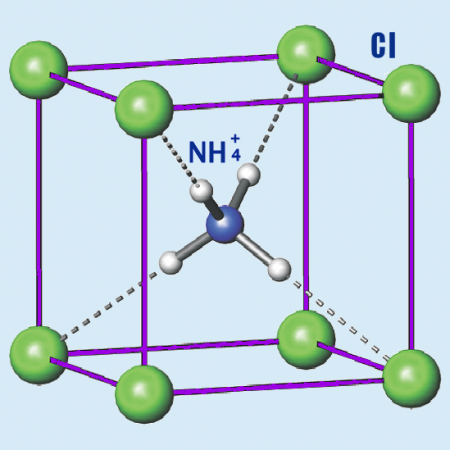
Молекула хлорида аммония
Реакции с хлоридом аммония
Хлористый аммоний проявляет сходные с другими солями аммония химические свойства. При взаимодействии с водой начинается реакция гидролиза – разложение вещества с образованием воды и ионов. При этом разрушается остаток основания (NH4OH), т.е. сольволиз протекает по катиону:
При нагревании образуется аммиак и соляная кислота:
Химическое разложение происходит под воздействием концентрированной серной кислоты:
а также при взаимодействии с щелочами щелочно-земельных металлов:
При этом обязательно выделяется хлороводородная кислота или аммиак.
Хлорид аммония реагирует с металлами с выделением нитрида водорода:
Взаимодействие с оксидами протекает тяжело, требует подогревания или участия катализаторов. Так, при температуре около 300°С идёт реакция с окисью меди:
При этом образуется молекулярный азот и выпадает чистая медь.
При слабом подогревании (60-70°С) или пропускании электрического тока нашатырь взаимодействует с хлором, образуя маслянистую летучую жидкость – трёххлористый азот:
Активно идут реакции с различными нитратами, например, с нитратом серебра:
Формирующийся осадок хлорида серебра белого цвета темнеет на свету.
Хлорид аммония реагирует и с нитритами: нитритом натрия, калия и других металлов:
История использования
Хлорид аммония – это вещество, которое было известно со времен до нашей эры. Впервые его использовали в Египте, получая путём возгонки (перехода из твёрдого состояния в газ). Печи топились верблюжьим навозом, в котором в изобилии был аммиак. В результате образовывалась сажа, из которой добывалось вещество. Нередко минерал находили в пустынях, в местах оазисов, где скапливался кал и моча ездовых животных. Резко пахнущие кристаллы использовали в мистических практиках жрецы бога Амона. Вдыхая едкий запах, люди ощущали рефлекторную стимуляцию дыхательного центра, онемение. Эти эффекты связывались с религиозным общением. Хлориду аммония дали название «нушадир», что в переводе с арабского означает «аммиак».
Спустя столетия, в период Средних веков, алхимики экспериментировали с хлористой солью аммония. Смешивая аммиак с летучий хлористоводородной кислотой, они видели образование густого белого дыма. Активную реакцию нейтрализации аммиака (основания) кислотой (HCl) они объясняли также с точки зрения мистики: считалось, что газы представляют собой богов, в результате сражения которых появляется дым и белый налёт на предметах.
По мере развития науки химики стали использовать кристаллы нашатыря в медицинских целях. Из него готовили водный раствор, в котором смачивали платки или марли для приведения в чувства людей, упавших в обморок. Порошок применялся в качества нюхательной соли при головных болях, в стрессовых ситуациях, при заболеваниях верхних и нижних дыхательных путей, для успокоения при истерических припадках. Безводный хлорид аммония не имеет запаха, однако со временем постепенно разлагается, выделяя аммиак, который и даёт местно-раздражающий эффект.
Сначала нашатырь импортировался в страны Европы и в Россию из Индии и Египта, затем учёные стали синтезировать его самостоятельно. Повсеместное активное применение вещества началось в 1710-1800 годах. В 1710 году в России был построен первый завод по производству хлористого аммония.
Получение и производство
В лабораторных условиях хлорид аммония получают взаимодействием аммиака с хлором:
Первые производственные методы получения хлористого аммония были основаны на нейтрализации водного раствора аммиаком соляной кислоты.
Сегодня большое количество Е510 производится как побочный продукт при выпуске пищевой соды. Общее уравнение реакции:
Производство проходит в несколько этапов:
- получают насыщенный раствор гидрокарбоната натрия (NaHCO3);
- отделяют бикарбанат;
- оставшийся маточный раствор упаривают для большей концентрации соединений;
- в раствор дополнительно добавляют хлориды, затем пропускают углекислый газ.
Так поступают заводы, специализирующиеся на производстве двууглекислого натрия. Для них наиболее экономически выгодно совмещать выпуск двух продуктов, поскольку в наличии изначально есть все необходимые реактивы.
Иногда получение хлорида аммония может быть не связано с пищевой содой. Для этого используют самую первую технологию – взаимодействие раствора аммиака и хлористоводородной кислоты. При этом производство идёт с участием крупного и дорогостоящего оборудования.
Исходный метод был усовершенствован, т.к. имел некоторые недостатки: выпаривание водного раствора для выделения нужного соединения происходило с затратами тепла, сопровождалось сильной коррозией выпарных устройств, в результате производитель нёс убытки. Поэтому было решено заменить водный раствор аммиака насыщенным растворов – таким, в котором концентрация вещества наибольшая, а содержание воды – наименьшее. Последовательность стадий производства:
- Чистый реагент синтетического хлористого водорода помещают в аппарат для поглощения газов. Туда же добавляют раствор хлористого аммония в жидкой форме. При температуре 70°С происходит реакция поглощения раствором газа.
- Насыщенный раствор, нагретый до 110°С, поступает в реактор.
- В реактор подаётся газообразный аммиак, который нейтрализует хлорид водорода.
- Образуется суспензия хлористого аммония, которая отстаивается.
- Расслоившийся раствор направляют в центрифугу, где хлорид аммония отделяется в виде кристаллов.
Выход вещества при таком способе довольно большой. Однако производитель сталкивается с токсичными и опасными реактивами, во время синтеза есть вероятность образования взрывоопасного трихлорида азота (Cl3N). Поэтому чаще всего вещество, поступающее в продажу, производится вместе с пищевой содой.
Воздействие на организм
При правильном применении хлорид аммония не оказывает негативного воздействия на организм. Нужно строго следовать рекомендациям лечащего врача, если вещество было назначено в качестве мочегонного, отхаркивающего средства.
Вред для организма, противопоказания, побочные эффекты
Частое или интенсивное вдыхание паров нашатыря может привести к ожогу слизистой, головным болям. Злоупотребление пищевыми продуктами, в состав которых входит Е510, может привести к отравлению, тошноте и болям в животе, аллергии.
Главное противопоказание к применению хлористого аммония – индивидуальная непереносимость. Она может выражаться в отёках, развитии тяжёлых аллергических реакций. Вещество противопоказано следующим группам лиц:
- беременным или кормящим женщинам;
- детям до 18 лет;
- людям с почечной недостаточностью и другими заболеваниями почек;
- при печёночной недостаточности, гепатитах.
Среди побочных эффектов после использования нашатыря головокружение, головная боль, тошнота, временная потеря или притупление вкусовой чувствительности, обоняния, а также сыпи, кашель.
Полезные свойства
Хлористый аммоний обладает выраженной фармакологической активностью. Воздействуя через рецепторы носа на дыхательный центр, он производит мощный раздражающий эффект. При этом активизируются базовые защитные рефлексы: кашель и чихание. Средство улучшает отхождение мокроты из нижних дыхательных путей при бронхите, пневмонии, способствует сужению сосудов полости носа (избавляет от насморка).
Хлорид аммония проявляет мочегонные свойства. При этом его принимают перорально в виде слабого раствора, который быстро всасывается в желудочно-кишечном тракте. Он вызывает отток жидкостей из тканей в кровь, а затем усиливает выделение и формирование мочи в почках, ускоряет процесс перехода первичной мочи во вторичную, вывод её из организма. Благодаря диуретикоподобному действию хлористый аммоний способствует устранению отёков и нормализации водно-щелочного баланса.
Допустимые нормы потребления хлорида аммония
Предельно допустимая доза хлористого аммония в сутки составляет 12 г в сутки для взрослых людей и 2,5 г в день для детей. Вещество разрешено к применению во многих странах мира, в том числе в США, Канаде, России.
Применение хлорида аммония
Хлорид аммония используется во многих сферах. Сегодня его значение в некоторых областях несколько уменьшилось (сельское хозяйство, пищевая промышленность), поскольку его заменили более совершенные вещества.
Применение хлорида аммония в пищевой промышленности
Пищевая добавка Е510 действует как эмульгатор. Добавка позволяет смешивать исходно трудно растворимые друг в друге соединения, стабилизирует и улучшает их структуру. При производстве хлебобулочной продукции хлористый аммоний добавляется как улучшитель муки. Пищевую добавку Е510 можно встретить в составе и других продуктов:
- кондитерские изделия;
- лакричные конфеты;
- плодово-ягодные вина;
- макароны;
- дрожжи;
- хлебобулочные изделия.
Применение хлористого аммония в пищевой промышленности ограничивается, поскольку иногда он даёт неприятный вкус и запах. Ему предпочитают безвкусные стабилизаторы. Однако в лакричной карамели аммиачный привкус пищевой добавки Е510 ценится.
Применение хлорида аммония в медицине
Хлорид аммония выпускается в виде желатиновых капсул, а также дозированного порошка для приготовления растворов. Препараты на основе этого вещества назначаются при следующих патологических состояниях:
- Острый бронхит.
- Пневмония неясного генеза.
- Обильная трудноотходящая мокрота.
- Застойная сердечная недостаточность, сопровождающаяся отёками.
- Болезнь Меньера.
- Синдром предменструального напряжения.
- Повышение водородного показателя крови (алкалоз).
Благодаря мягкому мочегонному действию хлористый аммоний может назначаться как индивидуально, так и в составе комплексной терапии для усиления других диуретиков. Важно не превышать предельно допустимую дозировку и обязательно консультироваться о возможности приёма средства с врачом.
Применение хлорида аммония в сельском хозяйстве
Иногда хлористый аммоний может использоваться в качестве прикорневого удобрения сельскохозяйственных культур. Для этого необходим порошок, содержащий не менее 25% азота. Внесение в почву данного вещества улучшает рост и развитие растений, плодоношение, повышает их продуктивность. В качестве подкормки используют водный раствор.
Недостаток удобрения в том, что более 65% в составе занимает хлор. Этот элемент токсичен для многих видов растений. Поэтому хлорид аммония чаще всего используют для подкормки малочувствительных к хлору культур:
При применении данного удобрения нужно стараться вносить его при перекопке грунта осенью, тогда есть вероятность, что большинство хлора вымоется осадками. В связи с этими трудностями в использовании, хлористый аммоний чаще всего заменяют более безопасными для сельскохозяйственных растений азотными удобрениями.
Применение хлорида аммония в других сферах
При перепайке различных устройств хлорид аммония удаляет оксиды с поверхности металлов, что улучшает эффективность спаивания.
За счёт высокой способности к сольволизу водой нашатырь используется как источник электрического тока в гальванических элементах. Также может быть источником обильного дымообразования, что необходимо в пиротехнических составах.
В лабораториях хлористый аммоний используется для исследования состава крови. Соединение приводит к гемолизу эритроцитов, в результате чего их оболочка разрывается, и гемоглобин выходит наружу, становится доступным для изучения.
Хлорид аммоний раньше применялся в фотографии как компонент фиксирующей жидкости.
Где купить и сколько стоит хлорид аммония
Хлористый аммоний продаётся оптом заводами-производителями. Цена варьирует от 25 до 28 рублей за 1 кг. Удобрение на основе этого вещества продаётся в магазинах, ориентированных на товары для сада и огорода. Стоимость пакета, содержащего 500 грамм порошка, около 95-100 рублей. Хлорид аммония продаётся в аптеках, стоимость порошкообразного препарата от 95 до 200 рублей.
Заключение
Хлорид аммония – это неорганическое вещество, насыщенное азотом и хлором, которое издревле применяется в медицинских целях. Оно обладает мочегонным и отхаркивающим действием. Вещество используют как пищевую добавку Е510 для эмульгирования и стабилизации состава ряда продуктов. Хлористым аммонием можно удобрять почву, улучшая азотное питание растений. Он высоко химически активен, образует устойчивые водные растворы, способные проводить электричество, которые применяются также в промышленности, фотографии, пиротехнике.
http://chem.ru/hlorid-ammonija.html
http://chtoikak.ru/xlorid-ammoniya.html