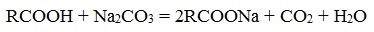Мыла: классификация, получение, свойства
С химической точки зрения мыла представляют собой соли высших жирных (C8–C18), нафтеновых или смоляных кислот.
В бытовом смысле — это технические продукты, обладающие моющим действием.
Классификация мыла
Существует несколько классификаций мыл.
По растворимости мыла делят на:
- Растворимые щелочные мыла — калиевые, натриевые, аммониевые соли жирных кислот. В зависимости от природы катиона мыла растворимость в воде увеличивается в ряду: Li + — Na + — K + — NH4 +
- нерастворимые металлические мыла — соли поливалентных металлов (Ca, Mg, Ni, Mn, Al, Co, Pb).
По консистенции:
- Жидкие мыла – соли калия, аммония
- Твердые мыла – соли натрия, лития, поливалентных металлов
По назначению:
По способу получения:
Химические способы получения мыла
Производство мыла (мыловарение) довольно длительный и сложный процесс, состоящий из нескольких стадий.
Если рассматривать только химические реакции, лежащие в основе получения мыла, то как уже было рассмотрено мыла можно получить при щелочном гидролизе жиров, при этом образуются глицерин и соли высших карбоновых кислот – мыла. Кроме этого мыла получаются при нейтрализации высших карбоновых кислот гидроксидом натрия или калия или углекислым натрием:
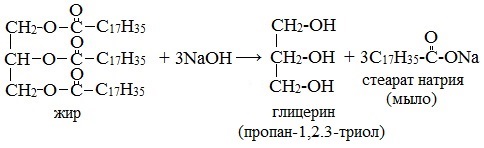
- Омыление триглицеридов гидроксидами натрия или калия
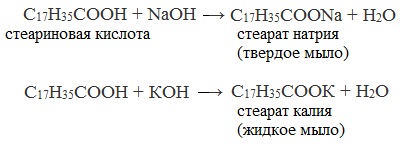
- Нейтрализация высших карбоновых кислот гидроксидом натрия (каустической содой) или гидроксидом калия
Твердые мыла получают при растворении высших карбоновых кислот в водном растворе гидроксида натрия, жидкие мыла — при растворении высших карбоновых кислот в водном растворе гидроксида калия.
- Нейтрализация высших карбоновых кислот углекислым натрием (кальцинированной содой):
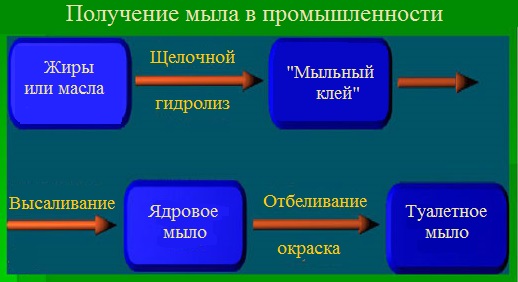
Промышленное получение мыла (варка мыла)
Для производства мыла в промышленности используют как синтетические жирные (высшие) кислоты, так и животные жиры, растительные масла, канифоль.
Для получения хозяйственных мыл применяют саломас с температурой плавления 46–60°С, для туалетного мыла — с температурой плавления 39–43°С.
Салома́с — это твёрдый жир, получаемый в промышленности путём гидрогенизации жидких жиров, в основном растительных масел.
Все жиры, используемые при варке мыла, не должны содержать воду и механические примеси.
Жидкие растительные масла применяют в мыловарении всех видов жидких хозяйственных и туалетных мыл. Наиболее ценным из является хлопковое масло, содержащее до 30 % насыщенных высших кислот, в основном пальмитиновой. Также используют и другие масла, такие как подсолнечное, соевое, кокосовое, пальмовое.
Введение небольших количеств жидких растительных масел в рецептуру хозяйственных мыл способствует снижению температуры их застывания.
Внесение 10–15 % канифоли увеличивает растворимость и пластичность мыла.
Основные стадии варки мыла
В промышленности мыла получают в две стадии – первая стадия химическая, вторая — механическая:
- Химическая стадия – варка мыла. Вначале проводят карбонатное омыление, при котором нейтрализуется около 70 % свободных жирных кислот. Затем проводят каустическое доомыление – нейтрализация оставшихся кислот гидроксидом натрия.
- Механическая стадия – охлаждение, сушка, шлифовка, отделка и упаковка готового продукта
Способы варки мыла
Варку мыла (химическая стадия) можно осуществить прямым и косвенным способом.
Для варки мыла прямым способом исходная жировая смесь должна быть хорошо очищена. Этим способом проводят нейтрализацию жировой смеси растворами содопродуктов и получают мыльный клей, содержащий 67–70 % жирных кислот. Далее его подвергают механической очистке — охлаждению, сушке, шлифовке, отделке. Прямой способ используется при варке хозяйственного мыла.
При варке мыла косвенным способом полученный прямым способом мыльный клей, подвергают дальнейшей обработке растворами электролитов, т.е. проводят высаливание. При этом происходит разделение мыльной массы на фазы: ядро и подмыльный щелок или ядро, подмыльный клей, подмыльный щелок. Полученное мыльное ядро в этом случае содержит 60–63 % жирных кислот. Далее полученное мыльное ядро обрабатывают подобно мылу, сваренному прямым способом. В качестве электролитов используют NaCl, NaOH. Косвенный способ применим для варки мыла из неочищенного жирового сырья. Варка мыла косвенным способом позволяет получить мыло высокой степени чистоты.
Жидкое мыло готовят из растительных масел, канифоли, таллового масли и др. прямым или косвенным способом. В качестве основания применяют соединения калия (KOH, K2CO3).
Если при варке мыла использовалось сырье из животных или растительных жиров, то после отделения ядра выделяют образующийся побочный продукт – глицерин. Глицерин широко применяют в различных отраслях производства.
Кратко схему производства мыла можно представить следующим образом:
Моющие свойства мыла
Итак, мыла – соли высших жирных кислот – состоят из аниона жирной кислоты и катиона металла (чаще всего натрия или калия).
В водных растворах щелочные мыла подвергаются гидролизу, т.к. образованы слабыми кислотами и сильными основаниями. Их растворы имеют щелочную реакцию (рН>7). В сильно разбавленных растворах мыла полностью диссоциируют на ионы:
Способность мыла пениться, отмывать загрязнения связана с образованием мицелл и высокой поверхностной активности. Водорастворимые щелочные мыла являются анионными поверхностно-активными веществами.
Углеводородный остаток жирной кислоты является гидрофобной частью мыла, кабоксильный ион – гидрофильной частью.
Этапы растворения грязи под действием мыла:
- При соприкосновении мыла с грязью, гидрофобная часть мыла окружает гидрофобное загрязняющее вещество и проникает внутрь, а поверхность загрязнения покрывается оболочкой гидрофильных групп.
- Гидрофильная часть мыла взаимодействуют с полярными молекулами воды.
- Ионы мыла «захватывают» загрязнение и отрываются от поверхности, переходя в воду.
- Плавающие частицы удерживаются в растворе до его смены.
В домашних условиях тоже можно приготовить мыло. Имея под рукой необходимые ингредиенты, самостоятельное производство мыла не составит большого труда.
Уравнение реакции получения мыла из жира
Известно несколько способов получения мыл.
- Нейтрализация кислот углекислым натрием (кальцинированной содой)
- Нейтрализация кислот гидроксидом натрия (каустической содой)
Жидкие калиевые мыла и твердые натриевые мыла получают растворением высших алифатических кислот в водных растворах едких щелочей:
- Омыление триглицеридов гидроксидом натрия
Получение мыла основано на реакции омыления — кипячением животного сала либо растительного масла с гидроксидом натрия или калия (гидролиз сложных эфиров жирных кислот (т.е. жиров) в присутствии щелочей), в результате которого образуется трехатомный спирт глицерин и соли высших карбоновых кислот (мыло):
Прямой способ. В специальных емкостях (варочных котлах) нагретые жиры омыляют едкой щёлочью (обычно гидроксидом натрия). Для гидролиза жира в щелочной среде берется немного топленого свиного сала, около 10 мл этилового спирта и 10 мл раствора щелочи.
В результате реакции в варочных котлах образуется однородная вязкая жидкость, густеющая при охлаждении — мыльный клей, состоящий из мыла и глицерина. Содержание жирных кислот в мыле, полученном непосредственно из мыльного клея обычно 40—60 %. Такой продукт имеет название «клеевого мыла».
Косвенный способ заключается в дальнейшей обработке мыльного клея.
Варку мыла заканчивают обработкой мыльного раствора (мыльного клея) избытком щелочи или раствором хлорида натрия. В результате этого на поверхность раствора всплывает концентрированный слой мыла, называемый ядром.
Он содержит не менее 60 % жирных кислот; нижний слой — подмыльный щёлок, раствор электролита с большим содержанием глицерина. (также содержит загрязняющие компоненты, содержавшиеся в исходном сырье).
Полученное мыло называют ядровым, а процесс его выделения из раствора – отсолкой или высаливанием.
Производство хозяйственного мыла заканчивают на стадии высаливания, при этом происходит очистка мыла от белковых, красящих и механических примесей. Производство туалетного мыла проходит все стадии механической обработки. Наиболее важной из них является шлифовка, т.е. переведение ядрового мыла в раствор кипячением с горячей водой и повторным высаливанием. При этом мыло получается особо чистым и светлым.
Для улучшения некоторых характеристик хозяйственного мыла, а также для удешевления в него вводят наполнители: некоторые натриевые соли, которые при растворении в воде приводят к подщелачиванию; клеи и крахмал – способствуют пенообразованию мыльного раствора и стойкости пены, однако моющей способностью не обладают.
Особое место среди наполнителей занимает сапонин, получаемый выщелачиванием некоторых растений и прежде всего мыльного корня. Он хорошо растворяется в воде и его растворы сильно пенятся. Сапонин применяют для дорогих сортов мыла.
При использовании в качестве щёлочи каустической соды получают твердое натриевое мыло. Мягкое или даже жидкое калиевое мыло образуется, когда применяется каустический поташ.
Главное условие красящих веществ, употребляемых для подкраски туалетного мыла, — это хорошее смешивание их с мылом и отсутствие вредного влияния на кожу.
Красный цвет для прозрачного мыла получают при помощи фуксина и эозина, для непрозрачного мыла используют киноварь и сурик. Желтый цвет мылу придает экстракт куркумы и пикриновая кислота. Для получения мыла зеленого цвета применяют зеленый анилин или хромовую зеленую краску. Коричневый цвет мыла образуется из светлой или темной коричневой анилиновой краски или жженого сахара.
В промышленности вместо щелочи применяют соду, а так как жиры являются одной из главных составляющих пищи человека, то за основу берут не животные жиры, а углеводороды, входящие в состав парафинов (нефти).
Мыла полученные из синтетических кислот аналогичны по своей химической природе обычным мылам.
Получение мыла из жира

ПОЛУЧЕНИЕ МЫЛА ИЗ ЖИРА
Составитель: учитель химии
Практическое занятие №4
Тема работы Получение мыла из жира
Цель работы 1) Получить мыло из жира.
2) Выделить мыло из реакционной смеси.
3) Установить наличие глицерина в реакционной смеси
после извлечения из неё мыла.
Оборудование Кристаллизатор с холодной водой, водяная баня,
лабораторный штатив, пробирка (20-25 мл), стеклянная
палочка, нагревательный прибор, спички, фильтровальная
Вещества Твёрдый жир (говяжий, бараний, свиной), 15%-ный
спиртовой раствор гидроксида натрия, 25%-ные растворы
хлорида натрия и сульфата меди (II).
Учитель объявляет классу, что на этом занятии они научатся получать мыло из жира. При этом им предстоит работать со щелочью и нагревательными приборами, поэтому необходимо придерживаться определенных правил техники безопасности и строго соблюдать ход работы, описанный в учебнике.
1. Инструктаж по технике безопасности
Учитель предлагает учащимся вспомнить, какие меры осторожности следует соблюдать при обращении с едкими жидкостями, со спиртовкой
1) Зажигать спиртовку горящей спичкой. Нельзя зажигать её от другой горящей спиртовки! Это может вызвать пожар. Гасят спиртовку, накрыв её колпачком.
2) Нагревая пробирку с жидкостью, держать её так, чтобы открытый конец её был направлен в сторону и от самого себя, и от соседей.
3) В случае попадания едкой жидкости на кожу или одежду немедленно обращаться к учителю или лаборанту.
2. Знание содержания работы
Учитель обращается к учащимся с просьбой описать содержание опытов, которые предстоит выполнить в ходе практической работы.
1) Мыла – соли ЩМ и жирных кислот. Поэтому получать мыло мы будем путем омыления жира раствором щелочи. (Учащиеся рассказывают, что для этого необходимо сделать).
2) Уравнение реакции омыления жира раствором щёлочи
СН2 – О – С – С17Н35
СН – О – С – С17Н35 + 3 NaOH = CH – OH + 3C17H35COONa
СН2 – О – С – С17Н35
3) Мыло из реакционной смеси будем выделять «высаливанием». (Учащиеся рассказывают, что для этого необходимо сделать).
4) Для установления наличия глицерина в реакционной смеси проведем качественную реакцию на глицерин – взаимодействие с гидроксидом меди (II). (Учащиеся рассказывают, что для этого необходимо сделать).
5) Уравнение качественной реакции на глицерин
CH2 – OH НО \ | Cu
| Cu = CH – O / + 2H2O
1. Получение мыла из жира
В большую колбу поместили 2 г жира и прилили 6 мл спиртового раствора щелочи. С помощью стеклянной палочки смесь тщательно перемешали и поставили в кипящую водяную баню. Нагревали содержимое пробирки в течение 10-15 мин, пока смесь не стала однородной.
2. Выделение мыла из реакционной смеси
К полученной однородной густой жидкости добавили 6-7 мл раствора поваренной соли. Жидкость помутнела и выделился (всплыл) слой мыла. При охлаждении слой мыла затвердел.
С помощью стеклянной палочки извлекли мыло из пробирки и просушили листком фильтровальной бумаги.
3. Установление наличия глицерина в реакционной смеси
К оставшемуся в большой пробирке раствору прилили около 2 мл раствора сульфата меди (II) и встряхнули образовавшуюся смесь. Сульфат меди (II) вступает в реакцию с оставшимся в реакционной смеси раствором гидроксида натрия. Образующийся при этом гидроксид меди (II) соединяется с глицерином с образованием глицерата меди (II). О чем свидетельствует появление синей окраски раствора.
1. Оформить практическую работу.
1. Зажигать спиртовку горящей спичкой. Нельзя зажигать её от другой горящей спиртовки! Это может вызвать пожар. Гасят спиртовку, накрыв её колпачком.
2. Нагревая пробирку с жидкостью, держать её так, чтобы открытый конец её был направлен в сторону и от самого себя, и от соседей.
3. В случае попадания едкой жидкости на кожу или одежду немедленно обращаться к учителю или лаборанту.
1. Мыла – соли ЩМ и жирных кислот. Поэтому получать мыло мы будем путем омыления жира раствором щелочи. Для этого в большую колбу поместим 2 г жира и прильём 6 мл спиртового раствора щелочи. С помощью стеклянной палочки смесь тщательно перемешаем и поставим в кипящую водяную баню. Содержимое пробирки будем нагревать в течение 10-15 мин, пока смесь не станет однородной.
2. Уравнение реакции омыления жира раствором щёлочи
СН2 – О – С – С17Н35
СН – О – С – С17Н35 + 3 NaOH = CH – OH + 3C17H35COONa
СН2 – О – С – С17Н35
3. Мыло из реакционной смеси будем выделять «высаливанием». Для этого к полученной однородной густой жидкости добавим 6-7 мл раствора поваренной соли. Жидкость помутнеет и выделится (всплывёт) слой мыла. Чтобы мыло затвердело реакционную смесь надо охладить.
Затем с помощью стеклянной палочки извлечём мыло из пробирки и просушим листком фильтровальной бумаги.
4. Для установления наличия глицерина в реакционной смеси проведем качественную реакцию на глицерин – взаимодействие с гидроксидом меди (II). Для этого к оставшемуся в большой пробирке раствору прильём около 2 мл раствора сульфата меди (II) и встряхнём образовавшуюся смесь. Сульфат меди (II) вступит в реакцию с оставшимся в реакционной смеси раствором гидроксида натрия. Образующийся при этом гидроксид меди (II) соединяется с глицерином с образованием глицерата меди (II). Поэтому раствор в пробирке должен будет окраситься в синий цвет.
http://himija-online.ru/organicheskaya-ximiya/mylo-sms/poluchenie-myla.html
http://pandia.ru/text/78/012/75927.php