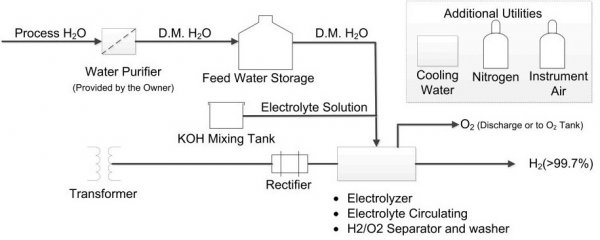
Получение водорода электролизом воды — технология и оборудование
Электролизом воды называется физико-химический процесс, при котором под действием постоянного электрического тока вода разлагается на кислород и водород. Постоянное напряжение для ячейки получается, как правило, выпрямлением трехфазного переменного тока. В электролитической ячейке дистиллированная вода подвергается электролизу, при этом химическая реакция идет по следующей известной схеме: 2Н2O + энергия —> 2H2+O2.
В результате разделения на части молекул воды, водорода по объему получается вдвое больше чем кислорода. Перед использованием газы в установке обезвоживаются и охлаждаются. Выходные трубопроводы установки всегда защищены возвратными клапанами для предотвращения возгораний.
Непосредственно каркас конструкции изготавливается из стальных труб и толстых листов стали, что придает всей конструкции высокую жесткость и механическую прочность. Газовые резервуары обязательно тестируются под давлением.
Электронный блок устройства контролирует все стадии процесса производства, и позволяет оператору следить за параметрами на панели и на манометрах, чем обеспечивает безопасность. Эффективность электролиза такова, что из 500 мл воды получается около кубометра обоих газов с затратами около 4 квт/ч электрической энергии.
По сравнению с прочими методами получения водорода, электролиз воды отличается целым рядом преимуществ. Во-первых, в ход идет доступное сырье — деминерализованная вода и электроэнергия. Во-вторых, во время производства отсутствуют загрязняющие выбросы. В-третьих, процесс целиком автоматизирован. Наконец, на выходе получается достаточно чистый (99,99%) продукт.
Поэтому электролизные установки и получаемый на них водород, находят сегодня применение во многих отраслях: в химическом синтезе, в термической обработке металлов, в производстве растительных масел, в стекольной промышленности, в электронике, в системах охлаждения в энергетике и т. д.
Установка для электролиза устроена следующим образом. Снаружи расположена панель управления генератором водорода. Далее установлены выпрямитель, трансформатор, распределительное устройство, система деминерализованной воды и блок для ее пополнения.
В электролитической ячейке на стороне катодной пластины получается водород, а на стороне анодной — кислород. Здесь газы покидают ячейку. Они разделяются и подаются в сепаратор, затем охлаждаются деминерализованной водой, после чего отделяются под действием гравитации от жидкой фазы. Водород направляется в промыватель, где из газа удаляются капли щелока и происходит охлаждение в змеевике.
Наконец, водород проходит фильтрацию (фильтр на верху сепаратора), где капельки воды полностью устраняются, и поступает в сушильную камеру. Кислород обычно направляется в атмосферу. Деминерализованная вода подается в промыватель насосом.
Щелок используют здесь для повышения электропроводности воды. Если эксплуатация электролизера идет штатно, то щелок пополняют единожды в год в небольшом количестве. Твердое едкое кали кладется в резервуар для щелока, заполненный на две трети деминерализованной водой, после чего насос перемешивает его в раствор.
Система водяного охлаждения электролизера служит двум целям: охлаждает щелок до 80-90°C и охлаждает полученные газы до 40°C.
Система анализа газа принимает пробы водорода. Капли щелока в сепараторе отделяются, газ подается к анализатору, давление понижается, проверяется содержание в водороде кислорода. Прежде чем водород будет направлен в резервуар, во влагомере будет измерена точка росы. Сигнал будет подан оператору или на ПК, чтобы решить, подходит ли полученный водород для направления в накопительный резервуар, соответствует ли газ условиям приема.
Рабочее давление установки регулируется при помощи системы автоматического контроля. Датчик получает информацию о давлении внутри электролизера, затем данные направляются на ПК, где сравниваются с заданными параметрами. Далее результат преобразуется в сигнал порядка 10 мА, и рабочее давление удерживается на заданном уровне.
Рабочая температура установки регулируется пневматическим мембранным клапаном. Компьютер аналогичным образом сравнит температуру с заданной, и разница будет преобразована в соответствующий сигнал для ПЛК.
Безопасность работы электролизера обеспечивается системой блокировки и сигнализации. В случае утечки водорода, обнаружение происходит автоматически детекторами. Программа при этом сразу отключает генерацию и запускает вентилятор для проветривания помещения. Переносной детектор утечки находится обязательно у оператора. Все эти меры позволяют достичь высокой степени безопасности при эксплуатации электролизеров.
Если Вам понравилась эта статья, поделитесь ссылкой на неё в социальных сетях. Это сильно поможет развитию нашего сайта!
Водород. Получение водорода.
Водород – широко распространенный элемент. Благодаря своей уникальности он может выступать в качестве окислителя и в качестве восстановителя. Существует несколько методов получения водорода.
Промышленный метод получения водорода .
1. Электролиз водных растворов солей (поваренная соль NaCl).
2. Пропускание паров поды над раскаленным коксом (Т = 1000 °С):
А на 2-ой стадии водяной газ пропускают над оксидом железа (III) при температуре около 450°С:
Часто эту реакцию называют реакцией сдвига.
3. Получение из природного газа. Основа – конверсия метана (основной компонент природного газа, СН4) с водяным паром. В итоге получается обратимая смесь, которая называется синтез-газом. Условия протекания процесса: никелевый катализатор и 1000°С:
Эту реакцию часто используют для получения водорода для реакции Габера (синтез аммиака).
4. Крекинг нефтяных продуктов.
Лабораторный метод получения водорода.
1. Под воздействием разбавленных кислот на металлы, которые стоят в ряду напряжения левее водорода.
2. Электролиз растворов кислот, щелочей на катоде выделяется водород.
Добыча водорода из воды: методы и получение в домашних условиях
Наука настолько быстро развивается, что ученые уже научились разными способами получать такой химический элемент как водород. В первую очередь, это делается для хорошей альтернативы в топливе для машин в будущем, чтобы автомобили больше не заправлять бензином. «H» станет отличной альтернативой для всего, если эта сфера поднимется на более высокий уровень. Его преимущество в экологичности!
На данный момент существует несколько способов по добыче этого элемента. Ниже будут рассмотрены все эти методы получения, а так же как добыть водород в домашних условиях.
Способы получения водорода
Методы получения веществ бывают промышленными и лабораторными. В промышленности их получают в больших объемах, а в лабораторных в небольших.
Электролизный метод
К промышленному методу относится электролиз воды. Электролиз, если объяснять просто — это разложение веществ под действием электрического тока. Сам процесс достаточно сложный.
Стоит знать, что такое электролиз, чтобы можно было разбираться дальше в этой теме. Это окислительно-восстановительный процесс, протекающий, который протекает на электродах (катиона и аниона), протекающий под действием электрического тока. Окислительно-восстановительный процесс предполагает, что после реакции несколько химических элементов из положительных станут отрицательными (анионами), и наоборот (катионами).
Разобравшись со значением названия, теперь нужно понять, как получают водород! Электролиз — 1 из самых простых способов.
Берется емкость. В нее заливается сода с водой. Внутрь кладутся 2 электрических элемента. 1 должен быть анодом (плюс), а второй (минус). Затем через содовый раствор пропускается электрический ток. Под действием тока водород отправляется к катоду, а вода (Н2О) к аноду.
Восстановление водяного пара металлами
Что происходит в этом случае? Металл взаимодействует с водой при нагревании. Чтобы жидкость превратилась в пар ее нужно нагреть минимум до 100 градусов. Металл+вода = реакция замещения. Образуется оксид и газообразный водород. Но вступать в такие реакции для образования впоследствии водорода могут далеко не все элементы металлов. Существует химическая таблица, в которой химические вещества расположены друг за другом в порядке уменьшения концентрации (слева направо). Все вещества, находящиеся после водорода (Н) не могут вступать в реакции замещения и, соответственно, не имеют возможности впоследствии образовывать газообразный водород.
Как получить нужный элемент?
Выделение водорода происходит следующим образом (с научной точки зрения):
Zn + H2O = ZnO + H2.
В начале был цинк и вода. Этот металл может участвовать в реакциях, т.к. он активнее водорода (находится левее). В результате Zn вытеснил Н из Н2О, встав на его место. Водород же остался «одиноким», простым веществом, выделившись в газообразном состоянии.
Точно такой же пример можно привести с магнием:
Mg + H2O = MgO + H2.
Из метана
Метан — органическое соединение (главный компонент природного газа). При окислении метана при наличии кислорода и воды при нагревании образуется углекислый газ(2СО2) и газ-водород (6Н2). Оба газа на выходе бесцветные, не имеющие вкуса и запаха.
Такую смесь необходимо разделить на отдельные компоненты (очистить водород от примесей углекислого газа). Для этого 2СО2 пропускают через известковую воду Са(ОН)2. Углекислый газ пропускают через бесцветную жидкость. В результате образуется нерастворимый остаток карбоната кальция. Н пройдет через воду без изменений. После пропускания известковая жидкость мутнеет. Это происходит из-за остаточных явления после 2СО2.
Восстановление водяного пара коксом
Кокс — это уголь (С). При взаимодействии кокса с водяным паром (с водой при нагревании) образуется оксид угарного газа и газообразный водород. Этот метод, в первую очередь, используется для получения Н. Этот способ используется для синтеза многих других веществ. Такую реакцию называют синтез-газ, т.е. получение 2-х газообразных элементов.
Мембранная сепарация
Тоже очень интересный метод выведения газообразного неметалла. Процесс довольно простой в описании.
СО (угарный газ), Н2О(воду) и СО2 (углекислый газ) пропускают через палладиевые решетки. Они состоят палладиево-серебряного сплава. Только 3 элемента могут пройти сквозь решетку. На выходе ученые получают 99% долгожданный водород.
Способ адсорбции
Для него в работу берутся твердые вещества (всем привычный активированный уголь). Его задача поглотить собой газовые смеси, чтобы на выходе получить Н2. Конечно, в работе также используют циклические адсорбенты (молекулярные сита), позволяющие в дальнейшем выделиться нужному веществу.
Свое название метод получил из-за адсорбентов — тех самых твердых веществ.
Взаимодействие металлов с разбавленными кислотами
Данный метод уже относится к лабораторному, т.е. на выходе уже не получится такого большого количества водорода.
Все та же реакция замещения. Металл может вступать в реакцию замещения, образуя соль кислоты и образуется газообразный Н. Отличия в том, что на место воды в химической формуле стоят кислоты (разбавленные):
Zn +HCl = ZnCl + H2
Mg + H2SO4 (серная кислота разбавленная) = MgSO4 + H2
Чаще всего в лаборатории используют цинк и магний, поэтому именно эта химическая формула наиболее популярна.
Электролиз воды
Последний способ, которым добывают водород — электролиз воды. Реакция происходит очень просто. Вода под действием электрического тока расщепляется на отдельные простые элементы воды и водорода. Отсюда и название (электролиз):
Это все способы получения водорода! Далее вы узнаете, как можно самостоятельно, своими руками создать настоящий прибор-генератор для получения Н2.
Добыча водорода в условиях домашнего хозяйства
Хоть получение водорода и кажется чем-то нереальным, его можно получить у себя дома на кухне. Но для этого вам понадобится электролизер. Без него никак! Ниже представлена инструкция, как его сделать!
P.S. В самом конце, когда вы уже запустите свое устройство — водород будет выделяться в воде в виде пузырьков, скапливающихся на ее поверхности!
Выбор электролизера
Электролизер — это емкость, в которую заливается содовый раствор и помещаются 2 электрода. Т.е. это основа, где в будущем будут получать водород. Для домашнего эксперимента нет смысла рассматривать сложные конструкции, требующие наличие разных инструментов, у большинства людей которых просто нет.
Также, на кухне мало у кого найдутся колбы для перемещения воды по ним, металлические крюки и прочие материалы. Поэтому ниже будет представлен способ, как можно собрать настоящий электролизер из простых инструментов, продающихся в стройматериалах. Перед началом работы ознакомьтесь с техникой безопасности!
Изготовление аппарата своими руками
Самый легкий и примитивный способ, как можно получить водород в домашних условиях — это с помощью электролиза. Чтобы создать генератор — ничего особенного не понадобится.
Следуйте пошаговой инструкции.
- Возьмите 2 болта диаметром 7 мм и 6 мм.
- В качестве электродов (катиона и аниона) используйте лезвия.
- Чтобы произошло разделение электродов — нарежьте пластиковую трубку с помощью канцелярского ножа на кусочки.
- Обматайте 1 часть лезвия скотчем.
- Внутри, где есть отверстие в само металлическое изделие проденьте болт, предварительно закрутив на нем изолятор.
- Крепко зажмите гайку болтика.
- С другой стороны лезвия точно также закрутите еще 1 болт.
- Возьмите пару болтиков и закрепите выходные контакты из медной проволоки к электродам.
- Контакты крепко закрепите, поставив их в вертикальное положение.
- С помощью изоляции для проводов изолируйте медную проволоку.
- Зажгите спичку и подержите контакты с изоляцией над огнем, чтобы их стенки соединились друг с другом.
- В крышке из-под банки проделайте 2 отверстия дрелью (наметьте карандашом, где нужны дырочки, поставив на крышку сверху концы от проволоки электрода).
- Вставьте в крышечку электроды с контактами.
- Проденьте проволоку с изоляцией как можно глубже в крышку, зафиксировав и в таком виде с помощью горячего клея.
- Закрутите крышку на банке. Основная часть генератора уже готова.
- Просверлите в банке еще 1 отверстие для выхода водорода.
- Отрежьте от медицинского шприца переднюю часть и закрепите ее на 3-ем отверстие.
- Закрепите пластиковый кончик на горячий клей.
- Налейте в банку воду и крепко закрутите крышку.
- Возьмите еще 1 новый шприц со смещенным центром.
- На его верхушке просверлите отверстие.
- Внутрь него проденьте тонкую трубочку.
- Закройте снизу шприц заглушкой, накрепко приклеенной.
- Саму деталь (водяной затвор) от генератора приклейте на скотч на банку.
- Возьмите пластиковую трубку и соедините выход водорода с водяным затвором.
- Далее понадобится вольтметр с «крокодилами», цепляющимися за контакты.
- При питании в 33 В начинает вырабатываться водород.
- Разряд можно поднять до 50 В, чтобы процесс получения водорода из воды протекал быстрее.
Теперь вы знаете, как сделать устройство для получения Н. Но стоит помнить о технике безопасности!
http://www.calc.ru/Vodorod-Polucheniye-Vodoroda.html
http://sila-vody.ru/ochistka-vody/v-kvartire/elektrolizom-vody-poluchenie-vodoroda.html