Физические свойства
В свободном состоянии железо — серебристо-белый металл с сероватым оттенком. Чистое железо пластично, обладает ферромагнитными свойствами. На практике обычно используются сплавы железа — чугуны и стали.
Fe — самый главный и самый распространенный элемент из девяти d-металлов побочной подгруппы VIII группы. Вместе с кобальтом и никелем образует «семейство железа».
При образовании соединений с другими элементами чаще использует 2 или 3 электрона (В = II, III ).
Железо, как и почти все d-элементы VIII группы, не проявляет высшую валентность, равную номеру группы. Его максимальная валентность достигает VI и проявляется крайне редко.
Наиболее характерны соединения, в которых атомы Fe находятся в степенях окисления +2 и +3.
Железо — общая характеристика элемента, химические свойства железа и его соединений

Основные степени окисления — +2, +3
Простое вещество железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
Химические свойства простого вещества — железа:
Ржавление и горение в кислороде
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа (II, III):
2) При высокой температуре (700–900°C) железо реагирует с парами воды:
3) Железо реагирует с неметаллами при нагревании:
Fe + S – t° → FeS (600 °С)
Fe+2S → Fe +2 (S 2 -1 ) (700°С)
4) В ряду напряжений стоит левее водорода, реагирует с разбавленными кислотами НСl и Н 2 SO 4 , при этом образуются соли железа(II) и выделяется водород:
Fe + 2HCl → FeCl 2 + H 2 (реакции проводятся без доступа воздуха, иначе Fe +2 постепенно переводится кислородом в Fe +3 )
В концентрированных кислотах–окислителях железо растворяется только при нагревании, оно сразу переходит в катион Фе 3+ :
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
Железный гвоздь, погруженный в голубоватый раствор медного купороса, постепенно покрывается налетом красной металлической меди
5) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Амфотерность железа проявляется только в концентрированных щелочах при кипячении:
и образуется осадок тетрагидроксоферрата(II) натрия.
Техническое железо — сплавы железа с углеродом: чугун содержит 2,06-6,67 % С, сталь 0,02-2,06 % С, часто присутствуют другие естественные примеси (S, Р, Si) и вводимые искусственно специальные добавки (Мn, Ni, Сr), что придает сплавам железа технически полезные свойства — твердость, термическую и коррозионную стойкость, ковкость и др .
Доменный процесс производства чугуна
Доменный процесс производства чугуна составляют следующие стадии:
а) подготовка (обжиг) сульфидных и карбонатных руд — перевод в оксидную руду:
б) сжигание кокса при горячем дутье:
в) восстановление оксидной руды угарным газом СО последовательно:
г) науглероживание железа (до 6,67 % С) и расплавление чугуна:
В чугуне всегда в виде зерен присутствуют цементит Fe 2 С и графит.
Производство стали
Передел чугуна в сталь проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева; температура процесса 1700-2000 °С. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (СО 2 , SО 2 ), либо связываются в легко отделяемый шлак — смесь Са 3 (РO 4 ) 2 и СаSiO 3 . Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Получение чистого железа в промышленности — электролиз раствора солей железа, например:
FеСl 2 → Fе↓ + Сl 2 ↑ (90°С) (электролиз)
(существуют и другие специальные методы, в том числе восстановление оксидов железа водородом).
Чистое железо применяется в производстве специальных сплавов, при изготовлении сердечников электромагнитов и трансформаторов, чугун — в производстве литья и стали, сталь — как конструкционный и инструментальный материалы, в том числе износо-, жаро- и коррозионно-стойкие.
Оксид железа(II) F еО . Амфотерный оксид с большим преобладанием основных свойств. Черный, имеет ионное строение Фе 2+ O 2- . При нагревании вначале разлагается, затем образуется вновь. Не образуется при сгорании железа на воздухе. Не реагирует с водой. Разлагается кислотами, сплавляется со щелочами. Медленно окисляется во влажном воздухе. Восстанавливается водородом, коксом. Участвует в доменном процессе выплавки чугуна. Применяется как компонент керамики и минеральных красок. Уравнения важнейших реакций:
4FеО ⇌(Fe II Fe 2 III ) + Fе (560—700 °С , 900—1000°С)
FеО + Н 2 =Н 2 O + Фе (особо чистое) (350°С)
FеО + С (кокс) = Фе + СО (выше 1000 °С)
ФеО + СО = Фе + СО 2 (900°С)
6ФеО + O 2 = 2(Fe II Fe 2 III )O 4 (300—500°С)
Получение в лаборатории : термическое разложение соединений железа (II) без доступа воздуха:
FеСОз = FеО + СO 2 (490-550 °С)
Оксид дижелеза (III) – железа( II ) ( Fe II Fe 2 III )O 4 . Двойной оксид. Черный, имеет ионное строение Fe 2+ (Fе 3+ ) 2 ( O 2- ) 4 . Термически устойчив до высоких температур. Не реагирует с водой. Разлагается кислотами. Восстанавливается водородом, раскаленным железом. Участвует в доменном процессе производства чугуна. Применяется как компонент минеральных красок ( железный сурик ), керамики, цветного цемента. Продукт специального окисления поверхности стальных изделий ( чернение, воронение ). По составу отвечает коричневой ржавчине и темной окалине на железе. Применение брутто-формулы Fe 3 O 4 не рекомендуется. Уравнения важнейших реакций:
2(Fe II Fe 2 III )O 4 = 6ФеО + O 2 (выше 1538 °С)
(Fe II Fe 2 III )O 4 + 4Н 2 = 4Н 2 O + 3Фе (особо чистое, 1000 °С)
(Fe II Fe 2 III )O 4 + СО =ЗFеО + СO 2 (500—800°C)
(Fe II Fe 2 III )O4 + Fе ⇌4FеО (900—1000 °С , 560—700 °С)
Получение: сгорание железа (см.) на воздухе.
В природе — оксидная руда железа магнетит.
Оксид железа(III) F е 2 О 3 . Амфотерный оксид с преобладанием основных свойств. Красно-коричневый, имеет ионное строение (Фе 3+ ) 2 (O 2- ) 3. Термически устойчив до высоких температур. Не образуется при сгорании железа на воздухе. Не реагирует с водой, из раствора выпадает бурый аморфный гидрат Фе 2 O 3 nН 2 О. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды — шпинели (технические продукты называются ферритами). Применяется как сырье при выплавке чугуна в доменном процессе, катализатор в производстве аммиака, компонент керамики, цветных цементов и минеральных красок, при термитной сварке стальных конструкций, как носитель звука и изображения на магнитных лентах, как полирующее средство для стали и стекла.
Уравнения важнейших реакций:
Fе 2 О 3 + МО=(М II Fе 2 II I )O 4 (М=Сu, Мn, Fе, Ni, Zn)
Fе 2 O 3 + ЗН 2 =ЗН 2 O+ 2Fе (особо чистое, 1050—1100 °С)
Получение в лаборатории — термическое разложение солей железа (III) на воздухе:
В природе — оксидные руды железа гематит Fе 2 O 3 и лимонит Fе 2 O 3 nН 2 O
Гидроксид железа (II) F е(ОН) 2 . Амфотерный гидроксид с преобладанием основных свойств. Белый (иногда с зеленоватым оттенком), связи Фе — ОН преимущественно ковалентные. Термически неустойчив. Легко окисляется на воздухе, особенно во влажном состоянии (темнеет). Нерастворим в воде. Реагирует с разбавленными кислотами, концентрированными щелочами. Типичный восстановитель. Промежуточный продукт при ржавлении железа. Применяется в изготовлении активной массы железоникелевых аккумуляторов.
Уравнения важнейших реакций:
4Fе(ОН) 2 (суспензия) + O 2 (воздух) →4FеО(ОН)↓ + 2Н 2 O (t)
Получение : осаждение из раствора щелочами или гидратом аммиака в инертной атмосфере:
Метагидроксид железа F еО(ОН). Амфотерный гидроксид с преобладанием основных свойств. Светло-коричневый, связи Фе — О и Фе — ОН преимущественно ковалентные. При нагревании разлагается без плавления. Нерастворим в воде. Осаждается из раствора в виде бурого аморфного полигидрата Фе 2 O 3 nН 2 O, который при выдерживании под разбавленным щелочным раствором или при высушивании переходит в ФеО(ОН). Реагирует с кислотами, твердыми щелочами. Слабый окислитель и восстановитель. Спекается с Фе(ОН) 2 . Промежуточный продукт при ржавлении железа. Применяется как основа желтых минеральных красок и эмалей, поглотитель отходящих газов, катализатор в органическом синтезе.
Соединение состава Fе(ОН) 3 не известно (не получено).
Уравнения важнейших реакций:
2FеО(ОН) + Fе(ОН) 2 =( Fe II Fe 2 III )O 4 + 2Н 2 O (600—1000 °С)
2FеО(ОН) + ЗН 2 = 4Н 2 O+ 2Фе (особо чистое, 500—600 °С)
2FеО(ОН) + ЗВr 2 + 10КОН = 2К 2 FеO 4 + 6Н 2 O + 6КВr
Получение: осаждение из раствора солей железа(Ш) гидрата Фе 2 О 3 nН 2 O и его частичное обезвоживание (см. выше).
В природе — оксидная руда железа лимонит Fе 2 O 3 nН 2 О и минерал гётит FеО(ОН).
Феррат калия К 2 F еО 4 . Оксосоль. Красно-фиолетовый, разлагается при сильном нагревании. Хорошо растворим в концентрированном растворе КОН, реагирует с кипящей водой, неустойчив в кислотной среде. Сильный окислитель.
Качественная реакция — образование красного осадка феррата бария. Применяется в синтезе ферритов — промышленно важных двойных оксидов железа (III) и других металлов.
Уравнения важнейших реакций:
FеО 4 2- + Ва 2+ = ВаFеO 4 (красн.)↓ (в конц. КОН)
Получение : образуется при окислении соединений железа, например метагидроксида ФеО(ОН), бромной водой, а также при действии сильных окислителей (при спекании) на железо
и электролизе в растворе:
(феррат калия образуется на аноде).
Обнаружение ионов Фе 2+ и Fе 3+ в водном растворе проводят с помощью реактивов К 3 [Fе(СN) 6 ] и К 4 [Fе(СN) 6 ] соответственно; в обоих случаях выпадает синий продукт одинакового состава и строения, КФе III [Fе II (СN) 6 ]. В лаборатории этот осадок называют берлинская лазурь , или турнбуллева синь :
Fе 2+ + К + + [Fе(СN) 6 ] 3- = КFе III [Fе II (СN) 6 ]↓
Fе 3+ + К + + [Fе(СN) 6 ] 4- = КFе III [Fе II (СN) 6 ]↓
Химические названия исходных реактивов и продукта реакций:
К 3 Fе III [Fе(СN) 6 ]- гексацианоферрат (III) калия
К 4 Fе III [Fе (СN) 6 ]- гексацианоферрат (II) калия
КFе III [Fе II (СN) 6 ]- гексацианоферрат (II) железа (Ш) калия
Кроме того, хорошим реактивом на ионы Фе 3+ является тиоцианат-ион НСС — , железо (III) соединяется с ним, и появляется ярко-красная («кровавая») окраска:
Fе 3+ + 6NСS — = [Фе(НСС) 6 ] 3-
Этим реактивом (например, в виде соли КНСС) можно обнаружить даже следы железа (III) в водопроводной воде, если она проходит через железные трубы, покрытые изнутри ржавчиной.
Железо (Fe)
Соединения железа:
Железо является самым распространенным металлом в земной коре (5,1% по массе) после алюминия.
На Земле железо в свободном состоянии встречается в незначительных количествах в виде самородков, а также в упавших метеоритах.
Промышленным способом железо добывают на железнорудных месторождениях, из железосодержащих минералов: магнитного, красного, бурого железняка.
Следует сказать, что железо входит в состав многих природных минералов, обуславливая их природную окраску. Окраска минералов зависит зависит от концентрации и соотношения ионов железа Fe 2+ /Fe 3+ , а также от атомов, окружающих эти ионы. Например, присутствие примесей ионов железа влияет на окраску многих драгоценных и полудрагоценных камней: топазов (от бледно-желтого до красного), сапфиров (от голубого до темно-синего), аквамаринов (от светло-голубого до зеленовато-голубого) и проч.
Железо содержится в тканях животных и растений, например, в организме взрослого человека присутствует около 5 г железа. Железо является жизненно важным элементом, оно входит в состав белка гемоглобина, участвуя в транспортировке кислорода от легких к тканям и клеткам. При недостатке железа в организме человека развивается малокровие (железодефицитная анемия).
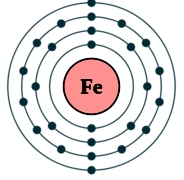
Рис. Строение атома железа.
Электронная конфигурация атома железа — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 2 электрона, находящихся на внешнем 4s-уровне + 6 электронов 3d-подуровня (всего 8 электронов), поэтому в соединениях железо может принимать степени окисления +8, +6, +4, +3, +2, +1, (наиболее часто встречаются +3, +2). Железо обладает средней химической активностью.
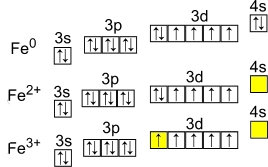
Рис. Степени окисления железа: +2, +3.
Физические свойства железа:
- металл серебристо-белого цвета;
- в чистом виде достаточно мягкий и пластичный;
- хобладает хорошей тепло- и электропроводимостью.
Железо существует в виде четырех модификаций (различаются строением кристаллической решетки): α-железо; β-железо; γ-железо; δ-железо.
Химические свойства железа
- реагирует с кислородом, в зависимости от температуры и концентрации кислорода могут образовываться различные продукты или смесь продуктов окисления железа (FeO, Fe2O3, Fe3O4):
3Fe + 2O2 = Fe3O4; - окисление железа при низких температурах:
4Fe + 3O2 = 2Fe2O3; - реагирует с водяным паром:
3Fe + 4H2O = Fe3O4 + 4H2; - мелко раздробленное железо реагирует при нагревании с серой и хлором (сульфид и хлорид железа):
Fe + S = FeS; 2Fe + 3Cl2 = 2FeCl3; - при высоких температурах реагирует с кремнием, углеродом, фосфором:
3Fe + C = Fe3C; - с другими металлами и с неметаллами железо может образовывать сплавы;
- железо вытесняет менее активные металлы из их солей:
Fe + CuCl2 = FeCl2 + Cu; - с разбавленными кислотами железо выступает в роли восстановителя, образуя соли:
Fe + 2HCl = FeCl2 + H2; - с разбавленной азотной кислотой железо образует различные продукты восстановления кислоты, в зависимости от ее концентрации (N2, N2O, NO2).
Получение и применение железа
Промышленное железо получают выплавкой чугуна и стали.
Чугун — это сплав железа с примесями кремния, марганца, серы, фосфора, углерода. Содержание углерода в чугуне превышает 2% (в стали менее 2%).
Чистое железо получают:
- в кислородных конверторах из чугуна;
- восстановлением оксидов железа водородом и двухвалентным оксидом углерода;
- электролизом соответствующих солей.
Чугун получают из железных руд восстановлением оксидов железа. Выплавку чугуна осуществляют в доменных печах. В качестве источника тепла в доменной печи используется кокс.
Доменная печь является очень сложным техническим сооружением высотой в несколько десятков метров. Она выкладывается из огнеупорного кирпича и защищается внешним стальным кожухом. По состоянию на 2013 год самая крупная доменная печь была построена в Южной Корее сталелитейной компанией POSCO на металлургическом заводе в городе Кванъян (объем печи после модернизации составил 6000 кубометров при ежегодной производительности 5 700 000 тонн).

Рис. Доменная печь.
Процесс выплавки чугуна в доменной печи идет непрерывно в течение нескольких десятилетий, пока печь не выработает свой ресурс.
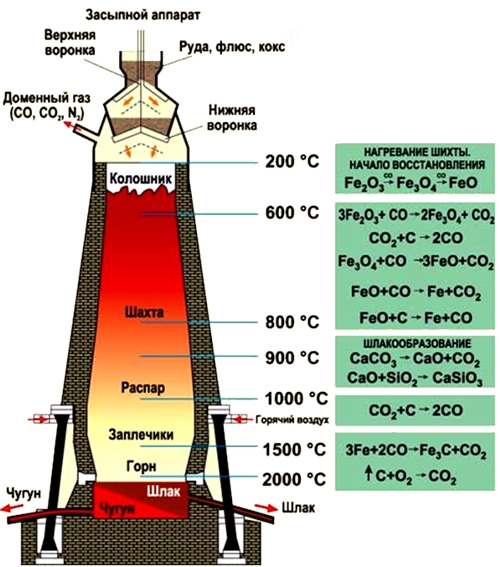
Рис. Процесс выплавки чугуна в доменной печи.
- обогащенные руды (магнитный, красный, бурый железняк) и кокс засыпаются через колошник, расположенный в самом верху доменной печи;
- процессы восстановления железа из руды под действием оксида углерода (II) протекают в средней части доменной печи (шахте) при температуре 450-1100°C (оксиды железа восстанавливаются до металла):
- 450-500°C — 3Fe2O3 + CO = 2Fe3O4 + CO2;
- 600°C — Fe3O4 + CO = 3FeO + CO2;
- 800°C — FeO + CO = Fe + CO2;
- часть двухвалентного оксида железа восстанавливается коксом: FeO + C = Fe + CO.
- параллельно идет процесс восстановления оксидов кремния и марганца (входят в железную руду в виде примесей), кремний и марганец входят в состав выплавляющегося чугуна:
- SiO2 + 2C = Si + 2CO;
- Mn2O3 + 3C = 2Mn + 3CO.
- при термическом разложении известняка (вносится в доменную печь) образуется оксид кальция, который реагирует с оксидами кремния и алюминия, содержащихся в руде:
- CaCO3 = CaO + CO2;
- CaO + SiO2 = CaSiO3;
- CaO + Al2O3 = Ca(AlO2)2.
- при 1100°C процесс восстановления железа прекращается;
- ниже шахты располагается распар, самая широкая часть доменной печи, ниже которой следует заплечник, в котором выгорает кокс и образуются жидкие продукты плавки — чугун и шлаки, накапливающиеся в самом низу печи — горне;
- в верхней части горна при температуре 1500°C в струе вдуваемого воздуха происходит интенсивное сгорание кокса: C + O2 = CO2;
- проходя через раскаленный кокс, оксид углерода (IV) превращается в оксид углерода (II), являющийся восстановителем железа (см. выше): CO2 + C = 2CO;
- шлаки, образованные силикатами и алюмосиликатами кальция, располагаются выше чугуна, защищая его от действия кислорода;
- через специальные отверстия, расположенные на разных уровнях горна, чугун и шлаки выпускаются наружу;
- бОльшая часть чугуна идет на дальнейшую переработку — выплавку стали.
Сталь выплавляют из чугуна и металлолома конверторным способом (мартеновский уже устарел, хотя еще и применяется) или электроплавкой (в электропечах, индукционных печах). Суть процесса (передела чугуна) заключается в понижении концентрации углерода и других примесей путем окисления кислородом.
Как уже было сказано выше, концентрация углерода в стали не превышает 2%. Благодаря этому, сталь в отличие от чугуна достаточно легко поддается ковке и прокатке, что позволяет изготавливать из нее разнообразные изделия, обладающие высокой твердостью и прочностью.
Твердость стали зависит от содержания углерода (чем больше углерода, тем тверже сталь) в конкретной марке стали и условий термообработки. При отпуске (медленном охлаждении) сталь становится мягкой; при закалке (быстром охлаждении) сталь получается очень твердой.
Для придания стали нужных специфических свойств в нее добавляют лигирующие добавки: хром, никель, кремний, молибден, ванадий, марганец и проч.
Чугун и сталь являются важнейшими конструкционными материалами в подавляющем большинстве отраслей народного хозяйства.
Биологическая роль железа:
- в организме взрослого человека содержится около 5 г железа;
- железо играет важную роль в работе кроветворных органов;
- железо входит в состав многих сложных белковых комплексов (гемоглобина, миоглобина, различных ферментов).
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
http://himege.ru/zhelezo-svojstva/
http://prosto-o-slognom.ru/chimia/510_zhelezo_Fe.html



