Уравнение реакции при горении водорода

Водород – рождающий воду. Вода получается при горении водорода — при соединении водорода с кислородом. В ходе реакции выделяется очень большое количество энергии.
Значит, водород – топливо. И как со всяким топливом с водородом нужно обращаться осторожно. Получаем водород реакцией цинка с соляной кислотой.
Поджигаем водород у конца газоотводной трубки. Вначале пламя едва заметно (водород не окрашивает пламя). Постепенно стеклянная трубка раскаляется, и пламя становится желтым: соединения натрия, входящие в состав стекла окрашивают пламя. Итак, водород – топливо. На водороде и кислороде могут работать реактивные двигатели. Теплоту реакции горения водорода используют для сварки и резки металлов, водород и ацетилен в этом смысле похожи. При сгорании водорода в чистом кислороде температура достигает 2800 о С. Такое пламя плавит кварц и большинство металлов. Важно, что водород – безвредное для окружающей среды топливо .
Оборудование: штатив, пробирка, пробирка с газоотводной трубкой, пинцет, лучина.
Техника безопасности . Следует соблюдать правила работы с горючими газами и правила работы с кислотами.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Температура горения водорода: описание и условия реакции, применение в технике
Одной из актуальных проблем является загрязнение окружающей среды и ограниченность энергетических ресурсов органического происхождения. Многообещающим способом решения этих проблем является использование водорода в качестве источника энергии. В статье рассмотрим вопрос горения водорода, температуру и химию этого процесса.
Что такое водород?
Прежде чем рассматривать вопрос, какая температура сгорания водорода, необходимо вспомнить, что собой представляет это вещество.

Водород — это самый легкий химический элемент, состоящий всего из одного протона и одного электрона. При нормальных условиях (давление 1 атм., температура 0 oC) он присутствует в газообразном состоянии. Его молекула (H2) образована 2 атомами этого химического элемента. Водород является 3-м по распространенности элементом на нашей планете, и 1-м во Вселенной (около 90 % всей материи).

Водородный газ (H2) не имеет запаха, вкуса и цвета. Он не токсичен, однако, когда содержание его в атмосферном воздухе составляет несколько процентов, то человек может испытывать удушье, по причине недостатка кислорода.
Любопытно отметить, что хотя с химической точки зрения все молекула H2 идентичны, физические свойства их несколько отличаются. Дело все в ориентации спинов электронов (они ответственны за появление магнитного момента), которые могут быть параллельными и антипараллельными, такую молекулу называют орто- и параводородом, соответственно.
Химическая реакция горения
Рассматривая вопрос, температуры горения водорода с кислородом, приведем химическую реакцию, которая описывает этот процесс: 2H2 + O2 => 2H2O. То есть в реакции участвуют 3 молекулы (две водорода и одна кислорода), а продуктом являются две молекулы воды. Эта реакция описывает горение с химической точки зрения, и по ней можно судить, что после ее прохождения остается только чистая вода, которая не загрязняет окружающую среду, как это происходит при сгорании органического топлива (бензина, спирта).

С другой стороны, эта реакция является экзотермической, то есть помимо воды она выделяет некоторое количества тепла, которое можно использовать для приведения в движение машин и ракет, а также для его перевода в другие источники энергии, например, в электричество.
Механизм процесса горения водорода
Описанная в предыдущем пункте химическая реакция известна любому школьнику старших классов, однако она является очень грубым описанием того процесса, который происходит в действительности. Отметим, что до середины прошлого века человечество не знало, как происходит горение водорода в воздухе, а в 1956 году за ее изучение была присуждена Нобелевская премия по химии.
В действительности, если столкнуть молекулы O2 и H2, то никакой реакции не произойдет. Обе молекулы являются достаточно устойчивыми. Чтобы горение происходило, и образовывалась вода, необходимо существование свободных радикалов. В частности, атомов H, O и групп OH. Ниже приводится последовательность реакций, которые происходят в действительности при горении водорода:
- H + O2 => OH + O;
- OH + H2 => H2O + H;
- O + H2 = OH + H.
Что видно из этих реакций? При горении водорода образуется вода, да, верно, но происходит это только, когда группа из двух атомов OH встречается с молекулой H2. Кроме того, все реакции происходят с образованием свободных радикалов, это означает, что запускается процесс самоподдержания горения.
Таким образом, ключевой момент в запуске этой реакции заключается в образовании радикалов. Они появляются, если поднести к кислород-водородной смеси горящую спичку, либо если нагреть эту смесь выше определенной температуры.
Инициация реакции
Как было отмечено, сделать это можно двумя способами:
- С помощью искры, которая должна предоставить всего 0,02 мДж теплоты. Это очень маленькое значение энергии, для сравнения скажем, что аналогичное значение для бензиновой смеси составляет 0,24 мДж, а для метановой — 0,29 мДж. С уменьшением давления энергия инициации реакции растет. Так, при 2 кПа она составляет уже 0,56 мДж. В любом случае, это очень маленькие значения, поэтому водород-кислородная смесь считается легко воспламеняющейся.
- С помощью температуры. То есть кислород-водородную смесь можно просто нагревать, и выше некоторой температуры она сама воспламенится. Когда это произойдет, зависит от давления и процентного соотношения газов. В широком интервале концентраций при атмосферном давлении реакция самовозгорания происходит при температурах выше 773-850 К, то есть выше 500-577 oC. Это достаточно высокие значения по сравнению с бензиновой смесью, которая начинает самовоспламеняться уже при температурах ниже 300 oC.
Процентное содержание газов в горючей смеси

Говоря о температуре горения водорода в воздухе, следует отметить, что не всякая смесь этих газов будет вступать в рассматриваемый процесс. Экспериментально установлено, что если количество кислорода меньше 6% по объему, либо если количество водорода меньше 4% по объему, то никакой реакции не будет. Тем не менее, пределы существования горючей смеси являются достаточно широкими. Для воздуха процентное содержание водорода может составлять от 4,1 % до 74,8 %. Отметим, что верхнее значение как раз соответствует необходимому минимуму по кислороду.
Если же рассматривается чистая кислород-водородная смесь, то здесь пределы еще шире: 4,1-94 %.
Уменьшение давления газов приводит к сокращению указанных пределов (нижняя граница поднимается, верхняя — опускается).
Также важно понимать, что в процессе горения водорода в воздухе (кислороде), возникающие продукты реакции (вода) приводят к уменьшению концентрации реагентов, что может привести к прекращению химического процесса.
Безопасность горения
Это важная характеристика воспламеняющейся смеси, поскольку она позволяет судить о том, происходит реакция спокойно, и можно ее контролировать, либо процесс имеет взрывной характер. От чего зависит скорость горения? Конечно же, от концентрации реагентов, от давления, а также от количества энергии «затравки».
К большому сожалению, водород в широком интервале концентраций способен к взрывному горению. В литературе приводятся следующие цифры: 18,5-59 % водорода в воздушной смеси. Причем на краях этого предела в результате детонации выделяется наибольшее количество энергии на единицу объема.
Отмеченный характер горения представляет большую проблему для использования этой реакции в качестве контролируемого источника энергии.
Температура реакции горения
Теперь мы подошли непосредственно к ответу на вопрос, какая низшая температура сгорания водорода. Она составляет 2321 К или 2048 oC для смеси с 19,6 % H2. То есть температура горения водорода в воздухе выше 2000 oC (для других концентраций она может достигать 2500 oC), и в сравнении с бензиновой смесью — это огромная цифра (для бензина около 800 oC). Если сжигать водород в чистом кислороде, то температура пламени будет еще выше (до 2800 oC).
Столь высокая температура пламени представляет еще одну проблему в использовании этой реакции в качестве источника энергии, поскольку не существует в настоящее время сплавов, которые могли бы работать длительное время в таких экстремальных условиях.
Конечно, эта проблема решается, если использовать хорошо продуманную систему охлаждения камеры, где происходит горение водорода.
Количество выделяемой теплоты
В рамках вопроса температуры горения водорода любопытно также привести данные о количестве энергии, которая выделяется во время этой реакции. Для разных условий и составов горючей смеси получили значения от 119 МДж/кг до 141 МДж/кг. Чтобы понять, насколько это много, отметим, что аналогичное значение для бензиновой смеси составляет около 40 МДж/кг.
Энергетический выход водородной смеси намного выше, чем для бензина, что является огромным плюсом для ее применения в качестве топлива для двигателей внутреннего сгорания. Однако, и здесь не все так просто. Все дело в плотности водорода, она слишком низка при атмосферном давлении. Так, 1 м3 этого газа весит всего 90 грамм. Если сжечь этот 1 м3 H2, то выделится около 10-11 МДж теплоты, что уже в 4 раза меньше, чем при сжигании 1 кг бензина (чуть больше 1 литра).
Приведенные цифры говорят о том, что для использования реакции горения водорода необходимо научиться хранить этот газ в баллонах с высоким давлением, что создает уже дополнительные сложности, как в технологическом вопросе, так и с точки зрения безопасности.
Применение водородной горючей смеси в технике: проблемы
Сразу необходимо сказать, что в настоящее время водородная горючая смесь уже используется в некоторых сферах человеческой деятельности. Например, в качестве дополнительного топлива для космических ракет, в качестве источников для выработки электрической энергии, а также в экспериментальных моделях современных автомобилей. Однако масштабы этого применения являются мизерными, по сравнению с таковыми для органического топлива и, как правило, носят экспериментальных характер. Причиной этому являются не только трудности в контроле самой реакции горения, но также в хранении, транспортировке и добыче H2.
Водород на Земле практически не существует в чистом виде, поэтому его необходимо получать из различных соединений. Например, из воды. Это достаточно популярный способ в настоящее время, который осуществляется с помощью пропускания электрического тока через H2O. Вся проблема заключается в том, что при этом расходуется больше энергии, чем потом можно получить путем сжигания H2.
Еще одна важная проблема — транспортировка и хранение водорода. Дело в том, что этот газ, ввиду маленьких размеров его молекул, способен «вылетать» из любых контейнеров. Кроме того, попадая в металлическую решетку сплавов, он вызывает их охрупчивание. Поэтому наиболее эффективным способом хранения H2 является использование атомов углерода, способных прочно связывать «неуловимый» газ.
Таким образом, применение водорода в качестве топлива в более-менее широких масштабах возможно, только если его использовать в качестве «сохранения» электричества (например, переводить ветровую и солнечную энергию в водород с помощью электролиза воды), либо если научиться доставлять H2 из космоса (где его очень много) на Землю.
Расчеты горения
Расчеты горения ведут по химическим уравнениям реакций, используя законы газового состояния: Бойля – Мариотта 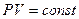
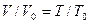
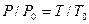
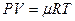
Рассмотрим реакцию горения водорода в кислороде: 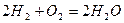
Рассмотрим реакцию горения метана в кислороде: 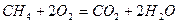
В практических условиях сжигание газа осуществляется в воздухе. Примем состав сухого воздуха: О2 – 21 %, N2 – 79%. Следовательно, 1 м 3 кислорода содержится в 100/21 = 4,76 м 3 воздуха. Или на 1 м 3 кислорода приходится 3,76 м 3 азота. Отсюда условная формула воздуха: (О2 + 3,76N2).
Запишем реакцию горения водорода в воздухе:
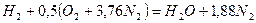
Из уравнения следует, что при нормальных условиях для полного сгорания 1 м 3 водорода требуется 0,5 × 4,76 = 2,38 м 3 воздуха. Таким образом, для сгорания 1 м 3 водорода требуется 2,38 м 3 воздуха. В результате образуются продукты сгорания: 1 м 3 воды в виде пара и 1,88 м 3 азота.
Запишем реакцию горения метана в воздухе:
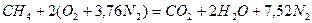
Из уравнения следует, что для полного сгорания 1 м 3 метана необходимо 2 × 4,76 = 9,52 м 3 воздуха. Таким образом, при нормальных условиях для сгорания 1 м 3 метана требуется 9,52 м 3 сухого воздуха. Продукты сгорания содержат 1 м 3 диоксида углерода, 2 м 3 паров воды и 7,52 м 3 азота.
Запишем реакцию горения пропана в воздухе:
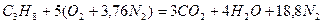
Из уравнения видно, что для полного сгорания 1 м 3 пропана необходимо 5 × 4,76 = 23,8 м 3 воздуха. Таким образом, при нормальных условиях для сгорания 1 м 3 пропана требуется 23,8 м 3 сухого воздуха.
Приведенные расчеты выполнены для стехиометрических уравнений и полученные соотношения воздуха и газа называются стехиометрическими. Например, для горения метана в воздухе стехиометрическое соотношение – 9,52. В реальных условиях воздуха может не хватать для полного сгорания газа или, напротив, воздух подается в избыточном количестве. Для характеристики реальных соотношений воздуха и газа в процессе горения введена безразмерная величина: коэффициент избытка воздуха (окислителя) – коэффициент α. Для стехиометрического соотношения α = 1. Если имеет место недостаток воздуха, то α 1. Например, в процессе горения израсходовано 23 м 3 воздуха и 2 м 3 метана. Подсчитываем коэффициент α. Реальное соотношение воздуха и газа 23/2 = 11,5. Отсюда α = 11,5/9,52 = 1,2.
Выше показано, как можно подсчитывать необходимое количество воздуха для сгорания и определять объем продуктов сгорания для индивидуальных газов. Но обычно используемый газ – смесь различных газов. В этом случае расчет теоретически необходимого объема воздуха (воздуха сухого) ведется по формуле:
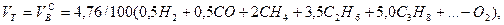
где 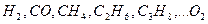
Используемый для сжигания атмосферный воздух содержит влагу, поэтому расчет объема влажного воздуха производят по формуле:
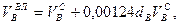
где 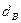
0,00124 – объем 1 г водяного пара.
И, наконец, определяется объем воздуха действительный с учетом величины коэффициента α по формуле:
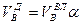
Пример. Имеется газ состава СН4 – 95%, С3Н8 – 5%. Определить объем воздуха действительного для сжигания данного газа при α = 1,1 и 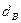

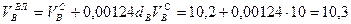
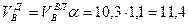
Объем продуктов сгорания газовой смеси определяется по следующим формулам.
Объем диоксида углерода
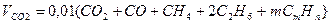
Объем водяных паров
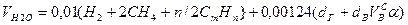
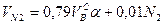
где N2 – процентное содержание азота в газовой смеси.
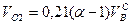
Суммарный объем продуктов сгорания

Дата добавления: 2015-06-22 ; просмотров: 8119 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://1ku.ru/obrazovanie/10670-temperatura-goreniya-vodoroda-opisanie-i-usloviya-reakcii-primenenie-v-texnike/
http://helpiks.org/3-94961.html






