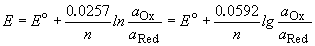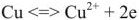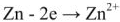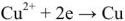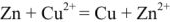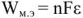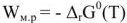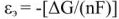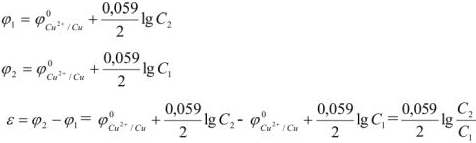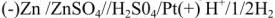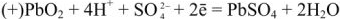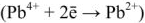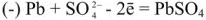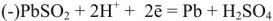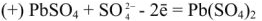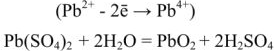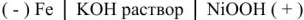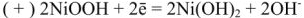Уравнение реакции протекающей в гальваническом элементе
Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля):
где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || — солевой мостик. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, называется катодом. Гальванический элемент принято записывать так, чтобы анод находился слева.
Электродные полуреакции принято записывать как реакции восстановления (таблица 12.1), поэтому общая реакция в гальваническом элементе записывается как разность между реакциями на правом и левом электродах:
Правый электрод: Cu 2+ + 2e = Cu
Левый электрод: Zn 2+ + 2e = Zn
Общая реакция: Cu 2+ + Zn = Cu + Zn 2+
Потенциал E электрода рассчитывается по формуле Нернста:
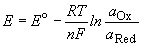
где aOx и aRed — активности окисленной и восстановленной форм вещества, участвующего в полуреакции; E o — стандартный потенциал электрода (при aOx = aRed =1); n — число электронов, участвующих в полуреакции; R — газовая постоянная; T — абсолютная температура; F — постоянная Фарадея. При 25 o C
Стандартные электродные потенциалы электродов измеряются относительно стандартного водородного электрода, потенциал которого принят равным нулю. Значения некоторых стандартных электродных потенциалов приведены в таблице 12.1.
Электродвижущая сила (ЭДС) элемента равна разности потенциалов правого и левого электродов:
Если ЭДС элемента положительна, то реакция (так, как она записана в элементе) протекает самопроизвольно. Если ЭДС отрицательна, то самопроизвольно протекает обратная реакция.
Стандартная ЭДС равна разности стандартных потенциалов:
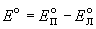
Для элемента Даниэля стандартная ЭДС равна
E o = E o (Cu 2+ /Cu) — E o (Zn 2+ /Zn) = +0.337 — (-0.763) = +1.100 В.
ЭДС элемента связана с 

Зная стандартную ЭДС, можно рассчитать константу равновесия протекающей в элементе реакции:
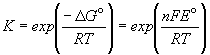
Константа равновесия реакции, протекающей в элементе Даниэля, равна
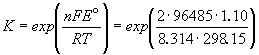
Зная температурный коэффициент ЭДС 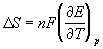




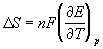
Таблица 12.1. Стандартные электродные потенциалы при 25 o С.
Электрод
Электродная реакция
E o , В
PbSO4 + 2H2O
Пример 12-1. Рассчитать стандартный электродный потенциал пары Cu 2+ /Cu + по данным таблицы 11.1 для пар Cu 2+ /Cu и Cu + /Cu.
Cu 2+ + 2e = Cu 
Cu + + e = Cu 
Cu 2+ + e = Cu + 
откуда E o = +0.153 В.
Пример 12-2. Составить схему гальванического элемента, в котором протекает реакция
Рассчитать стандартную ЭДС элемента при 25 o C, 
Ag | AgBr| Br — || Ag + | Ag
Правый электрод: Ag + + e = Ag E o = 0.7792 В
Левый электрод: AgBr + e = Ag + Br — E o = 0.0732 В
Общая реакция: Ag + + Br — = AgBr E o = 0.7260 В

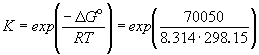
1/K= a(Ag + ) . a(Br — ) = m(Ag + ) . m(Br — ) . ( 



Отсюда, полагая 

Пример 12-3. 

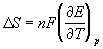



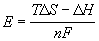
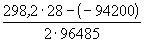
Ответ. 
12-1. Рассчитать стандартный электродный потенциал пары Fe 3+ /Fe по данным таблицы 12.1 для пар Fe 2+ /Fe и Fe 3+ /Fe 2+ . (ответ)
12-2. Рассчитать произведение растворимости и растворимость AgCl в воде при 25 o C по данным таблицы 12.1. (ответ)
12-3. Рассчитать произведение растворимости и растворимость Hg2Cl2 в воде при 25 o C по данным о стандартных электродных потенциалах. (ответ)
12-4. Рассчитать константу равновесия реакции диспропорционирования 2Cu + 
12-5. Рассчитать константу равновесия реакции ZnSO4 + Cd = CdSO4 + Zn при 25 o C по данным о стандартных электродных потенциалах. (ответ)
12-6. ЭДС элемента, в котором обратимо протекает реакция 0.5 Hg2Cl2 + Ag = AgCl + Hg, равна 0.456 В при 298 К и 0.439 В при 293 К. Рассчитать 


12-7. Вычислить тепловой эффект реакции Zn + 2AgCl = ZnCl2 + 2Ag, протекающей в гальваническом элементе при 273 К, если ЭДС элемента E= 1.015 В и температурный коэффициент ЭДС = — 4.02 . 10 -4 В . K -1 . (ответ)
12-8. В гальваническом элементе при температуре 298 К обратимо протекает реакция Cd + 2AgCl = CdCl2 + 2Ag. Рассчитать изменение энтропии реакции, если стандартная ЭДС элемента E o = 0.6753 В, а стандартные энтальпии образования CdCl2 и AgCl равны -389.7 и -126.9 кДж . моль -1 соответственно. (ответ)
12-9. ЭДС элемента Pt | H2 | HCl | AgCl | Ag при 25 o C равна 0.322 В. Чему равен pH раствора HCl . (ответ)
12-10. Растворимость Cu3(PO4)2 в воде при 25 o C равна 1.6 . 10 -8 моль . кг -1 . Рассчитать ЭДС элемента Pt | H2 | HCl (pH = 0) | Cu3(PO4)2 (насыщ. р-р) | Cu при 25 o C. (ответ)
12-11. Три гальванических элемента имеют стандартную ЭДС соответственно 0.01, 0.1 и 1.0 В при 25 o C. Рассчитать константы равновесия реакций, протекающих в этих элементах, если количество электронов для каждой реакции n = 1. (ответ)
12-12. ЭДС элемента Pt | H2 | HBr | AgBr | Ag в широком интервале температур описывается уравнением: E o (В) = 0.07131 — 4.99 . 10 -4 (T — 298) — 3.45 . 10 -6 (T — 298) 2 . Рассчитать 


12-13. Для измерения pH раствора можно применять хингидронный электрод. (Хингидрон, Q . QH2, представляет собой комплекс хинона, Q = C6H4O2, и гидрохинона, QH2 = C6H4O2H2). Электродная полуреакция записывается как Q + 2H + + 2e 
12-14. В гальваническом элементе обратимо протекает реакция CuSO4 + Zn = ZnSO4 + Cu. Рассчитать 

12-15. В элементе Вестона протекает реакция Cd + Hg2SO4 = Cd 2+ + 2Hg. Рассчитать ЭДС этого элемента при 303 K, если 

12-16. 


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
СХЕМА РАБОТЫ ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА И ТИПОВЫЕ ЗАДАЧИ
Фундаментальные законы физики и химии, и в том числе, закон сохранения массы и энергии вещества, находят свое подтверждение на уровне перемещения мельчайших частиц – электронов, массами которых в химии обычно пренебрегают.
Речь идет об окислительно-восстановительных процессах, сопровождающихся переходом электронов от одних веществ (восстановителей) к другим (окислителям). Причем вещества могут обмениваться электронами, непосредственно соприкасаясь друг с другом.
Однако существует множество случаев, когда прямого контакта веществ не происходит, а процесс окисления-восстановления все равно идет. А если он идет самопроизвольно, то при этом еще и энергия выделяется. Ее человек с успехом использует для выполнения электрической работы.
Реализуется такая возможность в гальваническом элементе, схема работы которого, а также расчеты, связанные с ним, рассматриваются в данной статье.
Простейший гальванический элемент: схема работы
Гальванический элемент – это прибор, позволяющий при посредстве химической реакции получить электрическую энергию.
Пластинка металла и вода: простые взаимоотношения
Давайте сначала разберемся, что происходит с пластинкой металла, если опустить ее в воду?
Процесс схож с диссоциацией соли: диполи воды ориентируются к ионам металла и извлекают их из пластины. Но почему же тогда не происходит растворения самой пластины в воде? Все дело в строении кристаллической решетки.
Кристаллы соли состоят из катионов и анионов, поэтому диполями воды извлекаются из решетки и те, и другие.
У металла же кристаллическая решетка представлена атомами-ионами. Внутри нее всегда происходит превращение атомов в катионы за счет отщепления валентных электронов и обратный процесс: катионы снова превращаются в атомы, присоединяя электроны. Электроны являются общими для всех ионов и атомов, присутствующих в кристаллической решетке металла.
Процессы внутри металлической кристаллической решетки в обобщенном виде можно показать так:
В итоге, вода, окружающая пластинку – это уже не собственно вода, а раствор, составленный из молекул воды и перешедших в нее из пластины ионов металла. На пластине же возникает избыток электронов, которые скапливаются у ее поверхности, так как сюда притягиваются гидратированные катионы металла.
Возникает так называемый двойной электрический слой.
Бесконечно катионы металла с пластины в раствор уходить не будут, поскольку существует и обратный процесс: переход катионов из раствора на пластину. И он будет идти до тех пор, пока не наступит динамическое равновесие:
На границе раздела «металлическая пластина – раствор» возникает разность потенциала, которая называется равновесным электродным потенциалом металла.
Пластинка металла и раствор его соли: к чему приводит такое соседство
А что произойдет, если металлическую пластинку поместить не в воду, а в раствор соли этого же металла, например, цинковую пластинку Zn в раствор сульфата цинка ZnSO4?
В растворе сульфата цинка уже присутствуют катионы цинка Zn 2+ . Таким образом, при погружении в него цинковой пластины возникнет избыточное количество этих катионов, и уже известное нам равновесие (см. выше) сместится влево. Все это приведет к тому, что отрицательный заряд на пластинке будет иметь меньшее значение, так как меньшее количество катионов с нее будет переходить в раствор. Как результат – более быстрое наступление равновесия и менее значительный скачок потенциала.
Потенциал металла в растворе его же соли в момент равновесия записывают так:
Металл, погруженный в раствор электролита, называют электродом, обратимым относительно катиона.
Цинк – достаточно активный металл. А если речь будет идти о медной пластинке Cu, погруженной в раствор, например, сульфата меди (II) CuSO4?
Медь – металл малоактивный. Двойной электрический слой, конечно же, появится и в этом случае. Но! Катионы из пластинки в раствор переходить не будут. Наоборот, катионы меди (II) Cu 2+ из раствора соли начнут встраиваться в кристаллическую решетку пластинки и создавать положительный заряд на ее поверхности. Сюда же подойдут сульфат-анионы SO4 2- и создадут вокруг нее отрицательный заряд. То есть распределение зарядов в данном случае будет совершенно противоположным, чем на цинковой пластинке.
Это общая закономерность: пластинки из малоактивных металлов при погружении в раствор их солей всегда заряжаются положительно.
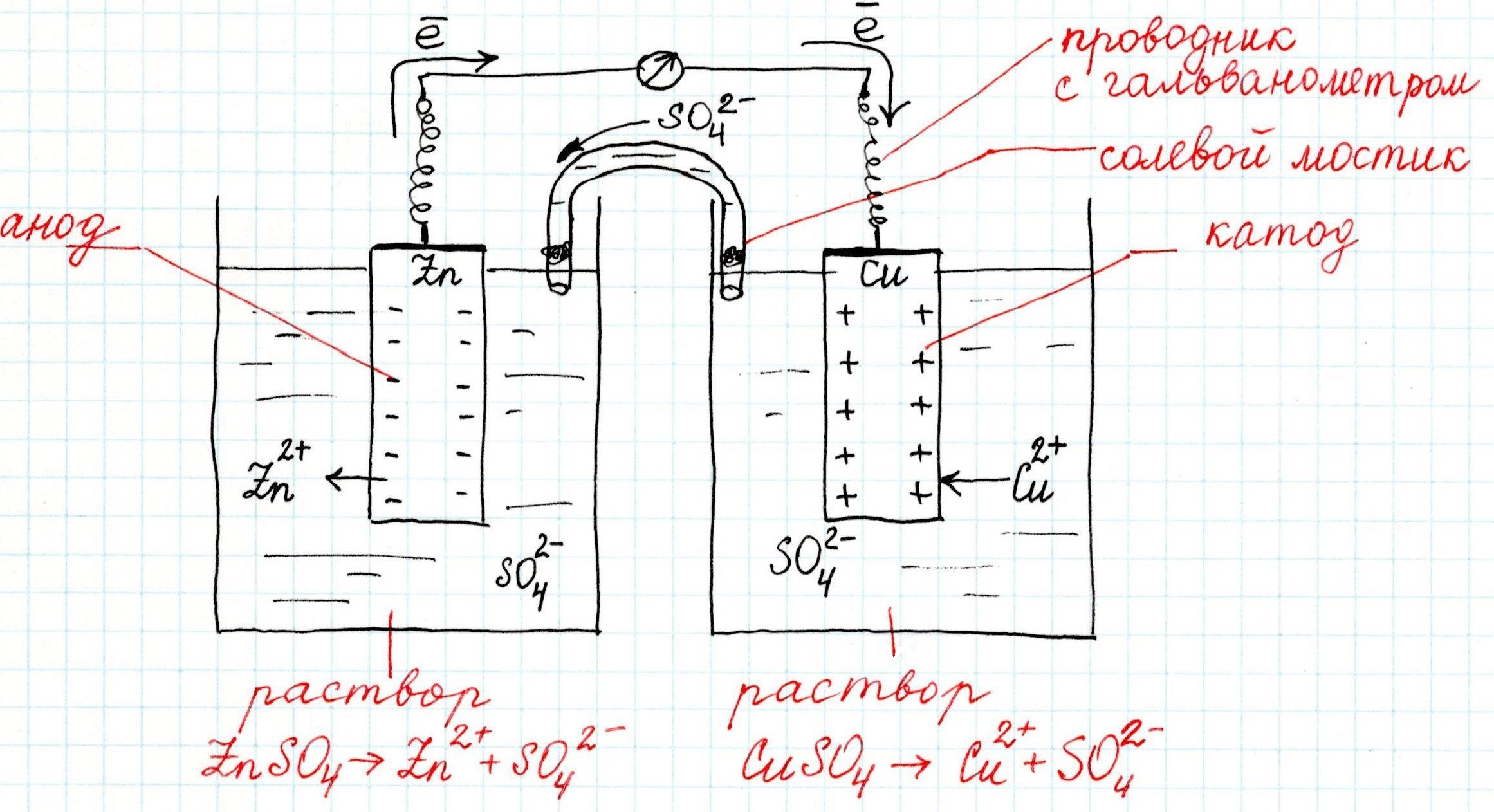
Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
Известно, что электрический ток – это направленное движение заряженных частиц (электронов).
На активном металле скапливаются электроны, а поверхность малоактивного металла, заряжается положительно. Если соединить проводником (например, металлической проволокой) оба металла, то электроны с одного перейдут на другой, а двойной электрический слой перестанет существовать. Это будет означать возникновение электрического тока.
Причем, ток возникает за счет окислительно-восстановительного процесса: активный металл окисляется (так как отдает электроны малоактивному), а малоактивный металл восстанавливается (так как принимает электроны от активного). Металлы друг с другом не соприкасаются, а взаимодействуют через посредника: внешнего проводника. Данная схема и есть схема гальванического элемента. Именно так устроен и работает гальванический элемент Даниэля-Якоби:
В схеме элемента показан «солевой мостик». Он представляет собой трубку, в которой присутствует электролит, не способный взаимодействовать ни с электродами (катодом или анодом), ни с электролитами в пространствах у электродов. Например, это может быть раствор сульфата натрия Na2SO4. Подобный мостик нужен для того, чтобы уравновешивать (нейтрализовать) заряды, образующиеся в растворах гальванического элемента.
Таким образом, возникшая электрическая цепь замыкается: анод → проводник с гальванометром → катод → раствор в катодном пространстве → «солевой мостик» → раствор в анодном пространстве → анод.
Анод – электрод, на котором происходит окисление (цинковая пластинка):
Электроны цинка Zn отправляются по внешней цепи (то есть по проводнику) на катод.
Катод – электрод, на котором происходит восстановление (медная пластинка):
Катионы меди Cu 2+ , пришедшие на пластинку из раствора сульфата меди (II), получают электроны цинкового анода.
В общем виде весь процесс окисления-восстановления в гальваническом элементе выглядит так:
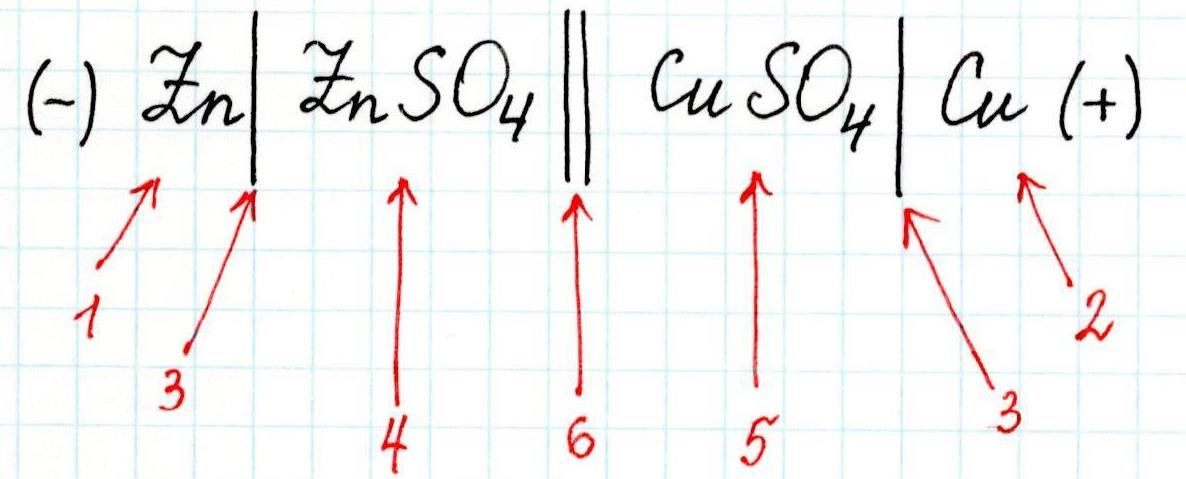
Для любого гальванического элемента можно составить запись в виде схемы. Например, для приведенного элемента Даниэля-Якоби она будет выглядеть так:
3 – скачок потенциала (граница раздела фаз);
4 – электролит в анодном пространстве;
5 – электролит в катодном пространстве;
6 – граница между растворами (солевой мостик).
Или сокращенно:
Типовые задачи на схему гальванического элемента: примеры решения
По вопросу, рассмотренному в данной статье, возможны два основных вида задач.
Задача 1. Составьте схему гальванического элемента, в котором протекает реакция:

Задача 2. Напишите электродные и суммарные уравнения реакций, протекающих в гальваническом элементе:

Итак, разобрав принцип работы гальванического элемента, мы научились записывать схему его работы и определять основные процессы на электродах.
Гальванический элемент в химии
Гальванический элемент (гэ). Напряжение гальванического элемента
Гальванический элемент — это, прибор, который преобразует химическую энергию окислительно-восстановительной реакции в электрическую энергию.
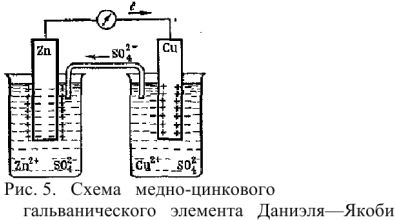
Схема простейшего ГЭ Даниэля-Якоби представлена на рис. 5.
Гальванический элемент состоит из двух электродов, каждый из которых опущен в сосуд с соответствующим раствором соли: цинковый электрод погружен в раствор соли 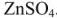
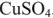
Сосуды соединены электролитическим мостиком, заполненным концентрированным раствором электролита (например, 

На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие
В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие
поэтому возникает электродный потенциал меди. Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходит от цинка к меди. В результате перехода электронов от цинка к меди равновесие на цинковом электроде сместиться вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместиться влево и произойдет разряд ионов меди.
Итак, при работе элемента Даниэля-Якоби протекают следующие процессы:
1) реакция окисления цинка
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами;
2) реакция восстановления ионов меди
Процессы восстановления в электрохимии получили название электродных процессов, а электроды, на которых идут процессы восстановления, назвают катодами;
3) движение электронов во внешней цепи;
4) движение ионов в растворе: через электролитический мостик анионов 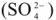
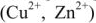
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток, поэтому суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей.
При схематической записи, заменяющей рисунок гальванического элемента, границу раздела между проводником 1-го рода и проводником 2-го рода обозначают одной вертикальной чертой, а границу раздела между проводниками 2-го рода — двумя чертами. Схема элемента Даниэля-Якоби, например, записывается в виде:
для упрощения в таких схемах обычно опускается внешняя цепь. Как видно, в гальваническом элементе идет химическая реакция, а во внешней цепи элемента протекает электрический ток, т.е. в гальваническом элементе происходит превращение химической энергии в электрическую.
Электродвижущая сила. Напряжение элемента. Электрическая работа равна произведению разности потенциалов электродов на количество электричества. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силон (ЭДС) элемента. Она равна разности равновесных потенциалов катода и анода элемента.
= 
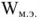
где 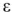
В то же время максимальная полезная работа 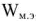
Так как 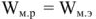
Значения термодинамических характеристик процесса получаются равными 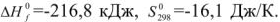
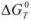
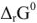
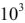
Согласно уравнения Нернста один и тот же электрод при различных концентрациях ионов имеет различное значение потенциала, поэтому возможны так называемые концентрационные ГЭ. Рассмотрим, например, ГЭ, составленный из двух медных электродов, опущенных в электролиты с разными концентрациями ионов 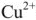
Схема такого ГЭ:
Положим, что 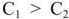
Работа в концентрационном ГЭ совершается не за счет реакции окисления восстановления, а за счет выравнивания концентрации растворов. Если концентрация электролитов отличаются в 10 раз, то напряжение (э.д.с.) ГЭ равна 0,0295 в, а если в 100 раз, то — 0,059 в.
Применяются для определения одной из концентраций 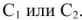
Концентрационная и химическая поляризация электронов.
На медном катоде в замкнутом элементе происходит восстановление ионов меди. При этом концентрация их при электродном слое снижается и тем сильнее, чем больше сила тока. Это затрудняет протекание реакции восстановления, и скорость катодной реакции определяется скоростью диффузии ионов к электроду. Уменьшение концентрации катионов меди по формуле Нернста приводит к уменьшению величины потенциала меди. Цинковый анод растворяется и тем с большей скоростью, чем больше сила тока. Это приводит к накоплению ионов цинка в приэлектродном слое, в результате чего его потенциал смещается по указанной причине в положительную сторону. Электроды в этом случае поляризуются благодаря изменению концентрации ионов у их поверхности. Такая поляризация носит название концентрационный или диффузионный.
В ряде случаев кроме поляризации, при протекании тока имеет место и так называемая химическая поляризация. Для иллюстрации этого явления составим следующую цепь:
В данном случае на платине восстанавливаются не ее ионы, поскольку их нет в растворе, а ионы водорода до атомного водорода, который адсорбируется на платине и частично растворяется в ней, а также превращается в молекулярный водород. Платиновый электрод, таким образом, превратится в водородный, т.е. изменится химическая природа электрода. При этом его потенциал сместится в отрицательную сторону. Иными словами, произойдет химическая поляризация катода, которая, как и концентрационная, приводит к уменьшению напряжения гальванического элемента.
Классификация гальванических элементов
Гальванический элемент состоит из двух электродов: катода (+) и анода (-) и из одного или дух электролитов, разделенных между собой пористой перегородкой, ограничивающей их смешивание. Известны типы гальванических элементов: химические, концентрационные,
окислительно-восстановительные. В гальваническую пару можно сочетать также электроды, принадлежащие к различным видам. При таком сочетании электродов не представляется возможным классифицировать элементы, исходя из природы электродов. Классификация окажется очень громоздкой. Поэтому элементы подразделяют по другим признакам: по особенностям работы, назначению и конструкциям.
Гальванические элементы делят на первичные химические источники тока и вторичные. К первичным относятся вес ранее рассмотренные элементы. Их можно использовать только один раз. После разряда они становятся непригодными к дальнейшей работе.
К вторичным относят аккумуляторы (накопители электричества). Аккумулятор после разряда можно снова зарядить, г.е. превратить продукты реакции путем электролиза в исходные вещества. При этом электрическая энергия превращается в химическую.
Первичные источники тока в свою очередь делят на элементы с жидким электролитом (наливные) и «сухие» (непроливающиеся) элементы с загущенным электролитом. Сухие элементы можно подразделить по признаку катодных деполяризаторов на элементы с твердыми окислителями, воздушной системы и смешанной марганцово-воздушной системы.
Аккумуляторы. Аккумуляторы — обратимые гальванические элементы.
Вещества, из которых изготовляют электроды, и электролиты подобраны в аккумуляторах с таким расчетом, чтобы обратимость химических процессов при электролизе (зарядке) достигалась с минимальной потерей энергии на побочные реакции и в виде теплоты.
Понятно, что медно-цинковый элемент с двумя разделенными пористой перегородкой растворами не пригоден в качестве аккумулятора. Так как происходящие в нем диффузионные процессы необратимы. При этом восстановление ионов цинка до металлического при зарядке будет сопровождаться побочной реакцией восстановления водорода.
Из огромного количества исследованных гальванических элементов удовлетворяют указанным требованиям свинцовый аккумулятор Плантэ, железо-никелевый (кадмиево-никелевый) аккумулятор Эдиссона и серебряно-цинковый аккумулятор Андре.
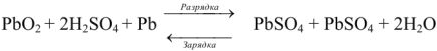
Свинцовый аккумулятор (рис. 6) был изобретен в результате работ Якоби, Плате и братьев Тюдор. В незаряженном виде он состоит из свинцовых пластин, отлитых в виде решеток. Отверстия отрицательных решеток заполнены пастой из свинцового глета РЬО и воды, а положительных — суриком 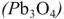

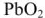
Перед использованием в аккумулятор наливают 30%-ый раствор серной кислоты.
При этом образуется гальваническая цепь:
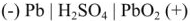
При разрядке аккумулятора на электродах протекают следующие реакции: на катоде
на аноде
Вещества катода и анода превращаются в сернокислый свинец, а химическая энергия — в электрическую.
При зарядке аккумулятора на электродах протекают следующие реакции:
на катоде
на аноде
Суммируя процессы зарядки и разрядки, получим:
В гальваническом элементе катод заряжен положительно, а анод -отрицательно. При электролизе, наоборот, катод заряжен отрицательно, а анод -положительно. Однако в любом случае на катоде протекает реакция восстановления, а на аноде — окисления. При зарядке и разрядке аккумулятора полярность электродов остается неизменной.
Исходя из равновесных потенциалов 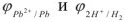
После того как на катоде закончится восстановление катионов свинца до металлического свинца, а на аноде — окисление 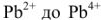
Емкость свинцового аккумулятора около 35вт/ч (20000 кулонов) на 1 кг веса. Последняя возрастает с повышением концентрации кислоты до некоторого предела; максимум емкости соответствует концентрации кислоты около 30% (плотность 1,224).
Свинцовый аккумулятор отдает около 80% подведенной к нему электроэнергии и дает примерно 4 а/ч на 1 дм2 поверхности пластин. Аккумулятор считают практически разряженным, если его напряжение на зажимах упало на 10% (от 2 в).
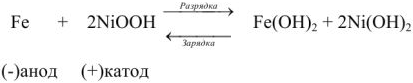
В щелочном аккумуляторе Эдиссона электродами служат порошкообразное железо и (гидрат окиси никеля, который частично дегидратируется до 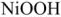
К электролиту часто добавляют гидрат окиси лития 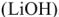
Электроды щелочных аккумуляторов изготавливают в виде пакетов из стальной стали с большим числом отверстий для прохода электролита к действующей массе, закладываемой в пакеты. При сборке пластины изолируют одну от другой эбонитовыми стержнями.
При разрядке на электродах протекают следующие процессы:
на катоде
на аноде
Напряжение щелочного аккумулятора равна 1,33 — 1,40 в.
При зарядке на катоде железо из гидрата закиси восстанавливается до металлического; на аноде 
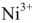
Суммарно процесс зарядки и разрядки можно изобразить следующим уравнением:
Максимальное напряжение при зарядке щелочного аккумулятора равно 1,8 в, конечное напряжение при разрядке 1 — 1,1 в. К.п.д. у щелочных аккумуляторов меньше, чем у свинцовых. Преимуществом щелочных аккумуляторов является их малый вес, простота ухода за ними, а также то обстоятельство, что случайные короткие замыкания не приносят такого вреда, как свинцовым аккумуляторам. При большой скорости образования сернокислого свинца он полу рыхлым, в результате чего электроды аккумулятора разрушаются.
Срок службы щелочных аккумуляторов в зависимости от электролита составляет 250-750 циклов.
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
http://himzadacha.ru/sxema-raboty-galvanicheskogo-elementa-i-tipovye-zadachi/
http://lfirmal.com/galvanicheskij-element-v-himii/