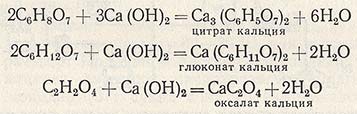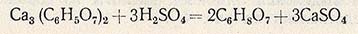Лимонная кислота
Лимонная кислота СН2СООН-СОНСООН-СН2СООН является трехосновной оксикислотой, кристаллизующейся из водных растворов с одной молекулой воды в виде бесцветных, прозрачных ромбической формы кристаллов.
Моногидратная форма лимонной кислоты имеет молекулярную массу 210, плотность 1,54 и температуру плавления 70-75 °С. При хранении и особенно быстро при нагревании до 40-50°С теряется кристаллизационная вода, при температуре 100 °С кристаллизационная вода теряется полностью.
При температуре кристаллизации 36,6 °С и выше выделяется безводная (температура плавления 153°С) лимонная кислота с молекулярной массой 192. При нагревании до 175°С кислота разлагается.
Лимонная кислота широко распространена в плодах и ягодах. Она находит применение в ряде отраслей пищевой промышленности (производство кондитерских изделий и напитков), химической и текстильной промышленности (окраска тканей, приготовление светочувствительных фотоэмульсий), медицине и т. д.
Мировое производство лимонной кислоты в настоящее время составляет около 130 тыс. т в год. При культивировании на углеводах в качестве продуцентов лимонной кислоты используют мутантные штаммы Asp. niger, на н-парафинах — дрожжи Candida lipolitica, Candida guilliermondii, Candida oleophila и бактериальные штаммы из рода Corynebacterium, Arthrobacter.
В Советском Союзе лимонную кислоту получают из мелассы микробиологическим синтезом, применяя главным образом микроскопические грибы Asp. niger, выращиваемые поверхностным или глубинным способом. Производство лимонной кислоты включает следующие основные технологические стадии: получение посевного материала, подготовку мелассы к сбраживанию, сбраживание растворов мелассы в лимонную кислоту с последующим отделением мицелия, выделение из сброженных растворов лимонной кислоты и получение ее в кристаллическом виде.
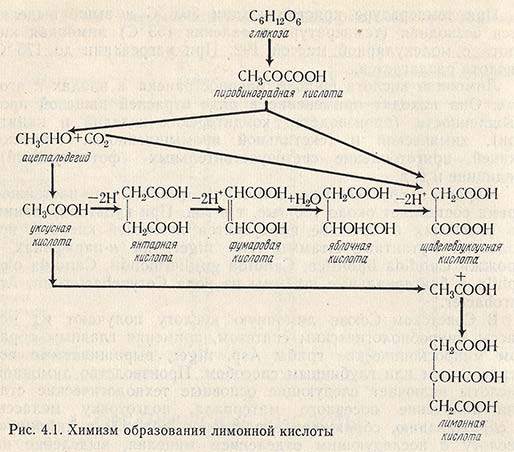
Химизм образования лимонной кислоты
Синтез лимонной кислоты связан с циклом дикарбоновых кислот и происходит в результате конденсации какой-либо кислоты, содержащей четыре атома углерода и две карбоксильные группы, с кислотой, имеющей два атома углерода и одну карбоксильную группу. Химизм образования лимонной кислоты представлен на рис. 4.1. В результате гликолиза глюкозы образуется пировиноградная кислота. На следующем этапе происходит ферментативное связывание пировиноградной кислоты с диоксидом углерода. Образовавшаяся щавелевоуксусная кислота вступает далее в реакцию с уксусной кислотой и образуется лимонная кислота. Таким образом, химизм образования лимонной кислоты включает реакции гликолиза и ряд реакций, замкнутых в цикл Кребса. При каждом обороте этого цикла молекула щавелевоуксусной кислоты вступает во взаимодействие с молекулой уксусной кислоты, образуя лимонную кислоту.
Получение посевного материала
Для производства лимонной кислоты поверхностным и глубинным способами используют отселекционированные штаммы Asp. niger. Исходные культуры хранят в виде сухих спор (конидий) в смеси с активным углем. Тщательно проверенная на микробиологическую чистоту и биохимическую активность музейная культура используется для приготовления посевного материала. Посевной материал размножают в пробирках с агаризованной средой (сусло-агар, среда Журавского и др.), а затем в колбах и кюветах — на твердой питательной среде. Длительность каждой стадии 2-7 сут, оптимальная температура выращивания 32 °С. В процессе выращивания на поверхности твердой среды развивается плотная мицелиальная пленка, которая затем покрывается конидиями. На последней стадии (из кювет) зрелые конидии собирают при помощи специального вакуумного устройства. Для удлинения срока хранения конидии подсушивают при 32 °С, смешивая со стерильным наполнителем — активным углем или тальком в соотношении 1:2. Обработанные таким способом конидии можно хранить 1-2 года. С 10 дм2 площади кювет получают 3-4 г сухих конидий (площадь одной кюветы 8,5 дм2). Готовый посевной материал фасуют в стерильные стеклянные колбы или банки вместимостью от 0,5 до 1 л. Посевной материал хранится при комнатной температуре и относительной влажности воздуха 70%. Гарантированный срок годности конидий не менее 6 мес. со дня выпуска.
Подготовка мелассы к сбраживанию
Многие органические вещества, главным образом сахара, сбраживаются с образованием лимонной кислоты. Хороший выход получают обычно, если используют в качестве источника углерода глюкозу, фруктозу, сахарозу, мальтозу. Для промышленного производства лимонной кислоты в качестве субстрата применяют обычно мелассу — отход сахарного производства.
Меласса — нестандартное сырье, ее химический состав зависит от качества сахарной свеклы, технологии переработки и условий хранения. Пригодность мелассы для производства лимонной кислоты определяют на основе предварительных биохимических испытаний. Растворы мелассы сбраживают поверхностной и глубинной культурой соответствующего штамма гриба Asp. niger. Меласса считается пригодной для производства лимонной кислоты поверхностным способом, если съем лимонной кислоты при контрольном сбраживании составляет не менее 1,25 кг/(м2-сут), глубинным способом — 10-12 кг/(м3-сут).
Хорошо сбраживаемые мелассы обычно содержат не более 1,0% инвертного сахара, 1% СаО, 0,06% SO2 при общем содержании сухих веществ не менее 75% и сахара более 46%. В зависимости от способа сбраживания мелассу разбавляют и готовят растворы с различной концентрацией сахара: для поверхностного выращивания Asp. niger до 13-15%, для глубинного культивирования — 3-4% и 25-28%. В приготовленных растворах серной кислотой доводят pH до 6,8-7,5. Необработанная меласса плохо ассимилируется и сбраживается микроорганизмом-продуцентом, так как наряду с веществами, необходимыми для нормального роста гриба и активного кислотообразования, в ней содержатся минеральные и ограничение примеси, тормозящие рост гриба и подавляющие процесс образования лимонной кислоты. Это ионы тяжелых металлов, в первую очередь железа.
Меласса, как было сказано выше, не единственный источник сырья для получения лимонной кислоты. За последние годы в различных странах мира запатентованы способы получения лимонной кислоты путем культивирования микроорганизмов, в основном дрожжей рода Candida, на средах, содержащих в качестве источника углерода н-парафины, глицерин, этанол, кислоты уксусную, масляную, животные или растительные жиры.
Сбраживание растворов мелассы
Поверхностный способ. При поверхностном способе сбраживания подготовленная меласса подается в варочный котел, где разбавляется кипящей водой в соотношении 1:1, pH раствора доводится до значения 6,8-7,2. При кипячении вводится раствор желтой кровяной соли для осаждения железа и солей тяжелых металлов с таким расчетом, чтобы избыток свободного ферроцианида, поскольку он угнетает развитие микроорганизма, не превышал 10 мг %. В раствор мелассы при температуре 60-70°С последовательно добавляют источники фосфора (обычно стерильный раствор фосфата калия) и другие минеральные вещества, например сульфат цинка, стимулирующий биосинтез лимонной кислоты и рост мицелия. Для активного биосинтеза лимонной кислоты в питательной среде кроме сахара должны содержаться 0,07% азота, 0,016-0,021% Р2O5, цинк, магний, калий и другие элементы в небольших количествах. Готовая среда температурой 45-50 °С передается в бродильные камеры. Культивирование гриба осуществляется в кюветах из нержавеющей стали толщиной 2 мм или из алюминия марки АО-МО толщиной 4-5 мм, установленных на стеллажах. После предварительной стерилизации камер парами формалина, дегазации газообразным аммиаком и охлаждения до 30-40 °С воздухом производится (начиная с верхних) заполнение кювет питательной средой. В зависимости от высоты борта кювет питательный раствор наливают слоем от 8 до 18 см. В камере предусмотрена система вентиляции для подачи нагретого (до 30-32°С) стерильного кондиционированного воздуха из расчета 3-18 м3/ч на 1 м2 поверхности кювет. В питательную среду через воздуховоды с помощью специального устройства для распыления вносят посевной материал из расчета 50-75 мг конидий на 1 м2 площади кювет.
При поверхностном способе различаются 3 режима культивирования: бессменный, бессменный с доливами и односменный.
При бессменном режиме гриб Asp. niger культивируется на одной и той же питательной среде до окончания процесса кислотообразования. При односменном режиме культивирования примерно через 7 сут сброженный раствор мелассы сливается и после промывки пленки стерильной водой заливается новый раствор. Наиболее эффективным режимом культивирования является так называемый бессменный способ с доливом. Суть его заключается в том, что раствор мелассы в количестве 30-35% начального объема вводится под пленку гриба. Долив питательной среды производится один или несколько раз, начиная с 4-5-х суток роста, через каждые 36-48 ч. Добавляемый раствор мелассы содержит 8,5-11,0% сахара и не имеет в своем составе питательных солей и антисептиков. Такой режим обеспечивает увеличение съема лимонной кислоты с 1 м2 бродильной поверхности на 15-20 % и снижает удельный расход мелассы на 10-15 % по сравнению с другими методами.
В первые 24-36 ч, когда происходит интенсивный рост мицелия гриба, температуру поддерживают в пределах 34-36 °С. Для аэрации на каждый квадратный метр растущего мицелия подают 3-4 м3/ч воздуха. В период активного кислотообразования температуру раствора снижают до 32-34 °С, а подачу воздуха увеличивают до 15-18 м3/(м2-ч). По мере снижения интенсивности кислотообразования и уменьшения количества выделяемого тепла подачу воздуха в камеру постепенно снижают. Ежедневно, начиная с 5-х суток, отбирают пробы для определения титруемой кислотности и остаточного сахара. Брожение прекращают, когда в растворе остается 1-2% сахара и общая титруемая кислотность в сброженном растворе достигает 12-20%. Сброженный раствор сливают в сборник. Для промывки мицелия под грибную пленку подливают горячую воду. После слива промывных вод мицелий по вакуум-линии транспортируют в запарник, где мицелий отмывают от кислоты горячей водой. Кислые растворы (концентрация 2,5-6,0%), собранные из-под ложного днища запарника, подают на фильтр-пресс. Выгруженный из запарника с помощью шнека мицелий используется на корм скоту.
При поверхностном способе брожения основные растворы содержат от 12 до 20% органических кислот в пересчете на лимонную кислоту, 0,5-2,0% несброженных сахаров и другие продукты метаболизма. Лимонная кислота в сброженных растворах составляет 94-98%.
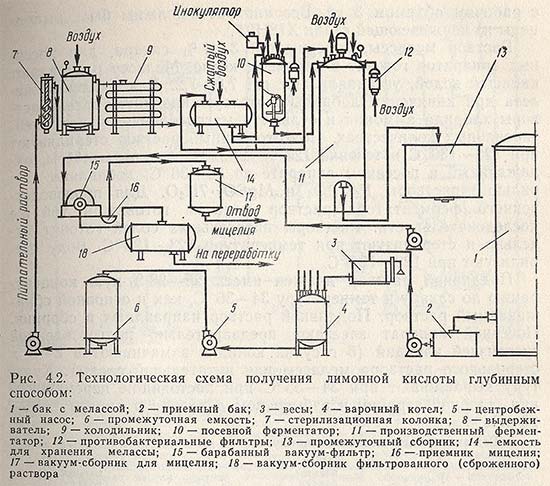
Глубинный способ. При глубинном способе сбраживания мелассных растворов процесс ведут в ферментаторах вместимостью 50 м3, разовая загрузка — 38 м3 (рис. 4.2). Конидии проращивают в посевных аппаратах вместимостью 5 м3 с рабочим объемом 3 м3. Все аппараты должны быть выполнены из нержавеющей стали Х18Н9Т.
Раствор мелассы, содержащий 3-4% сахара, для посевных аппаратов готовят в варочном котле. Мелассу разбавляют кипящей водой, устанавливают pH 7,0-7,2. Для удаления железа при кипячении добавляют желтую кровяную соль. Растворы хлорида аммония и сульфата магния вводят в регламентированных количествах. Подготовленный раствор стерилизуют при 128-130 °С в течение 12-15 мин. В раствор мелассы, охлажденный в посевном аппарате до 35-36 °С, добавляют стерильные растворы К2НРО4 и MgSO4-7H2O. Для производственного ферментатора раствор мелассы готовят в той же последовательности. Растворы питательных солей готовят отдельно и стерилизуют при температуре 123-125 °С. Воду стерилизуют при 128-130 °С.
Подливной раствор должен иметь 25-28%-ную концентрацию по сахару и температуру 34-36 °С, как и основной сбраживаемый раствор. Подливной раствор направляют в сборник. Посевной аппарат засевают предварительно подготовленной суспензией конидий (3 г сухих конидий замачивают в 2-3 л стерильного раствора мелассы или питательной среды). Культуру выращивают при 34-35°С при постоянном перемешивании, дробной аэрации и избыточном давлении в аппарате 10-20 кПа.
В период интенсивного вспенивания среды (12-24 ч) небольшими порциями подают пеногаситель (олеиновая кислота). Процесс подращивания мицелия заканчивается к 30-36 ч. Общая титруемая кислотность культуральной жидкости составляет 1,0-2,0%. Подращенный мицелий передают для засева среды производственного ферментатора.
Процесс кислотообразования продолжается 5-7 сут при температуре 31-32 °С, непрерывном перемешивании и дробной аэрации.
Начиная со 2-х суток после посева по мере снижения концентрации сахара в растворе проводят 2-3 подкормки. Дробное введение подливного 25-28%-ного раствора обычно проводят из расчета доведения конечной концентрации сахара в сбраживаемом растворе до 12-15%. Контроль за нарастанием титруемой кислотности и расходом сахара позволяет вовремя определить конец процесса и получить наибольший съем лимонной кислоты с 1 м3 ферментатора в сутки (не ниже 7,5 кг/м3). После окончания процесса сброженный раствор нагревают острым паром до 60-65 °С и сливают в сборник, откуда его подают на вакуум-фильтр для отделения и промывки мицелия горячей водой. Отделенный и промытый мицелий направляется на корм скоту. Основной раствор лимонной кислоты вместе с промывными водами передается в химический цех.
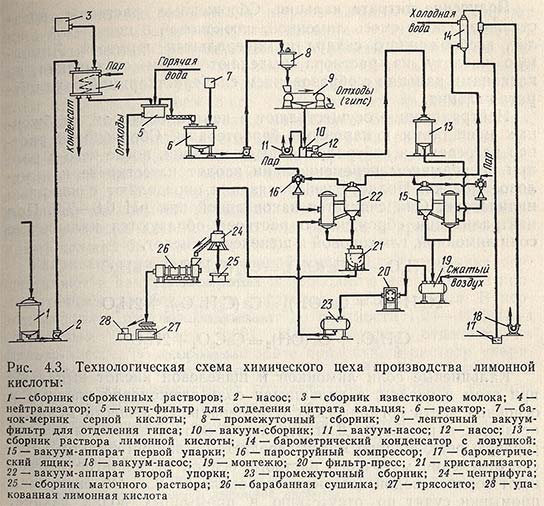
При глубинном способе сбраживания основные растворы содержат от 5 до 12 % органических кислот, 0,2-1,5% сахара, а лимонная кислота составляет 80-98% °т суммы всех кислот. Схема выделения лимонной кислоты из сброженных растворов представлена на рис. 4.3.
Получение цитрата кальция
Сброженные растворы представляют собой смесь лимонной, глюконовой и щавелевой кислот, несброженного сахара и минеральных примесей. Лимонную кислоту из раствора выделяют путем связывания ее катионами кальция с образованием слаборастворимой соли цитрата кальция.
Нейтрализацию осуществляют в нейтрализаторах, снабженных мешалками и паровыми барботерами. Сброженный раствор нагревают в нейтрализаторе до кипения, после чего в него при непрерывном перемешивании вводят известковое или меловое молоко. Полноту нейтрализации определяют с помощью индикатора. Она считается законченной при pH 6,8-7,5. При нейтрализации сброженного раствора образуются кальциевые соли лимонной, глюконовой и щавелевой кислот.
Кальциевые соли лимонной и щавелевой кислот выпадают при этом в осадок, а кальциевая соль глюконовой кислоты и основная часть органических и минеральных веществ мелассы остаются в растворе. Для отделения образовавшегося осадка горячую реакционную массу передают на вакуум-фильтры. После отделения маточного раствора осадок на фильтре промывают горячей водой (температура около 95 °С). Об окончании промывки судят по отсутствию в промывных водах сахара. Для подсушивания через осадок в течение некоторого времени пропускают воздух.
Перевод лимонной кислоты в свободное состояние и отделение ее от оксалата кальция достигается обработкой осадка серной кислотой с последующим фильтрованием. Разложение цитрата кальция осуществляют в реакторе, снабженном мешалкой и паровым барботером. В реактор подают воду из расчета 0,25-0,5 м3 на 1 т лимонной кислоты и при работающей мешалке загружают туда цитрат кальция с таким расчетом, чтобы после его разложения концентрация лимонной кислоты в растворе была не меньше 25%. В качестве осветлителя в реактор вводят активный уголь (2% к массе лимонной кислоты), содержимое реактора нагревают до 60 °С и при перемешивании подают из мерника серную кислоту (плотность 1,80-1,84) из расчета 0,425 л на 1 кг лимонной кислоты в цитрате. Смесь кипятят в течение 10-20 мин.
Разложение цитрата кальция серной кислотой протекает по уравнению
После полного разложения цитрата кальция (контролируют по отсутствию в среде цитрата кальция и серной кислоты) в реактор вводят гранулированный сернистый барий (из расчета 0,10-0,15 кг на 100 кг лимонной кислоты) для осаждения тяжелых металлов. Для отделения раствора лимонной кислоты от осадка, содержащего гипс, оксалат кальция, уголь, сернистые соединения тяжелых металлов и берлинскую лазурь, горячую реакционную смесь направляют из реактора на вакуум-фильтр. Отфильтрованный раствор передают на дополнительное упаривание, а осадок на фильтре промывают горячей водой (90°С). Промывку осадка прекращают при содержании лимонной кислоты в промывной воде 0,1 %. Средняя концентрация раствора лимонной кислоты (вместе с промывными водами) должна быть не ниже 16%.
Упаривание раствора лимонной кислоты
Упаривание осуществляют в вакуум-аппаратах и проводят в две стадии с промежуточным освобождением раствора от осадка гипса. В первом аппарате раствор упаривают до плотности 1,24-1,26 (под остаточным давлением 0,021 МПа), осадок отделяют на фильтр-прессе. Во втором аппарате прозрачный раствор упаривают (под остаточным давлением 0,021 МПа) до плотности 1,35-1,36, что соответствует концентрации лимонной кислоты 80% (около 1070 г моногидрата в 1 л).
Кристаллизация и сушка лимонной кислоты
Из вакуум-аппарата вторично упаренный раствор температурой 70 °С передают на кристаллизацию.
После заполнения кристаллизатора раствор охлаждают до 35-37 °С и вносят в него затравку — кристаллы лимонной кислоты. Кристаллизацию проводят при непрерывном перемешивании и медленном охлаждении до температуры 8-10 °С. При конечной температуре кристаллизации раствор выдерживают не менее 30-45 мин. Кристаллы отделяют в центрифуге, промывают их небольшим количеством холодной воды, затем кристаллы влажностью 2-3% передают на сушку.
Сушку проводят в ленточных или барабанных пневматических сушилках при температуре воздуха не более 35 °С. При: более высокой температуре происходит разрушение кристаллов вследствие потери ими кристаллизационной воды. В товарном продукте должно содержаться не менее 99,5% лимонной кислоты (в пересчете на моногидрат), зольность не более 0.1% для высшего сорта и 0,35% для I сорта.
«Изучение свойств карбоновых кислот на примере лимонной кислоты»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Муниципальное бюджетное общеобразовательное учреждение
Московского района г. Н. Новгорода
«Изучение свойств карбоновых кислот на примере лимонной кислоты»
Глава 1. Обзор литературы по теме исследования
1.1 Характеристика карбоновых кислот……………………………………………6
1.1.1 Номенклатура и изомерия карбоновых кислот……………………………..6
1.1.2 Химические и физические свойства Карбоновых кислот………………….7
1.1.3 Получение карбоновых кислот……………………………………………..10
1.2 Характеристика лимонной кислоты…………………………………………..11
1.2.1 Получение лимонной кислоты в промышленности……………………. 12
1.2.2 Особенные свойства лимонной кислоты и ее солей……………………. 13
1.2.3 Применение лимонной кислоты…………………………………………. 14
Глава 2. Материалы и методика исследования…………………………………. 17
Глава 3. Результаты и их обсуждение…………………………………………….19
Кислоты – необходимые для жизни человека химические соединения. Вместе с едой мы получаем растительные и животные белки, которые расщепляются на отдельные аминокислоты. Их них в каждом организме строятся свои белковые структуры, свои живые ткани. Органические кислоты в свободном виде поступают в человеческий организм с молочнокислыми продуктами, ягодами, фруктами, овощами. Некоторые из них являются витаминами, например, аскорбиновая, фолиевая, никотиновая и др. Молочная кислота образуется в мышцах при физической нагрузке.
Муравей впрыскивает в ранку при укусе яд, содержащий муравьиную кислоту, ее выделяют некоторые гусеницы, пчелы. Она содержится в стрекательных клетках медуз. Тропический паук стреляет во врагов струйкой жидкости, содержащей уксусную кислоту.
Лимонная кислота, в наибольшей концентрации, содержится в ряде растений, в ягодах, плодах цитрусовых, хвое, и недозрелых лимонах. Яблочная кислота — в незрелых яблоках, винограде, малине, рябине и других кислых растениях; муравьиная кислота обнаружена в хвое, крапиве, фруктах. Синильная кислота (сильнейший яд) содержится в небольших количествах в косточках слив, вишен или миндаля; винная кислота — в кислом соке многих фруктов (например, в винограде). Аскорбиновой кислотой наиболее богаты плоды свежего шиповника, чёрной смородины и облепихи; фолиевая кислота в значимых количествах содержится в зелёных листовых овощах, в некоторых цитрусовых, в бобовых.
Лимонная кислота широко используется как вкусовая добавка, улучшает энергетический обмен, что способствует ускорению метаболизма.
Предмет исследования: физико-химические свойства лимонной кислоты.
Цель исследования : исследовать физические и химические свойства лимонной кислоты, как представителя карбоновых кислот..
• Провести анализ литературных источников по составу, свойствам карбоновых кислот, лимонной кислоты.
• Провести химический анализ физических и химических свойств лимонной кислоты.
• Изучить и дать сравнительную анализ физических и хических свойтсв лимонной кислоты.
Лимонная кислота всегда есть в человеческом организме. Ее производные — соли, выполняют важную роль при формировании костей, помогая регулировать размер кристаллов кальция. В биохимии соли данной кислоты имеют большое значение в качестве промежуточного звена в цикле трикарбоновых кислот, который имеет место при метаболизме у всех аэробных организмов. Обладает лимонная кислота и ценными лечебными свойствами. Она способствует очищению организма от вредных веществ, лишних солей, шлаков, положительно влияет на работу систем пищеварения, улучшает зрение, сжигает углеводы, проявляет ценные противоопухолевые свойства, повышает иммунитет. Лимонная кислота также способствует выведению токсинов через клетки кожи [1] .
С другой стороны, сухая лимонная кислота и её концентрированные растворы при попадании в глаза вызывают сильное раздражение, при контакте с кожей возможно слабое раздражение. При употреблении внутрь больших количеств лимонной кислоты возможны: раздражение слизистой оболочки желудка, кашель, боль, кровавая рвота. При вдыхании пыли сухой лимонной кислоты — раздражение дыхательных путей. Высокая концентрация данного вещества, применяемая наружу или внутрь, является причиной серьезных ожогов. Также лимонная кислота является разрушителем зубной эмали, вступая с ней в реакцию из-за нейтрализации кальция. Страдающим желудочно-кишечными заболеваниями не рекомендуется (а в некоторых случаях даже запрещено) употреблять продукты, имеющие в своем составе Е330. Также ограничить их употребление или исключить из своего меню следует лицам с повышенной кислотностью, так как поступление в организм лимонной кислоты вызовет ухудшения состояния здоровья, может стать причиной сильных желудочных болей.
Глава 1. Обзор литературы по теме исследования
1.1 Характеристика карбоновых кислот.
Карбоновые кислоты – органические вещества, молекулы которых содержат одну или несколько карбоксильных групп.
Общая формула одноосновных карбоновых кислот CnH2nO2 .
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
Ø Одноосновные — 1 карбоксильная группа
Ø Двухосновные — 2 карбоксильных группы
Ø Трехосновные — 3 карбоксильных группы
По типу углеродного радикала на:
Высшие карбоновые кислоты называют жирными кислотами [2].
1.1.1. Номенклатура и изомерия карбоновых кислот.
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
Ø Метановая — HCOOH — муравьиная кислота
Ø Этановая — CH3-COOH — уксусная кислота
Ø Пропановая — C2H5-COOH — пропионовая кислота
Ø Бутановая — C3H7-COOH — масляная кислота
Ø Пентановая — C4H9-COOH — валериановая кислота
Алгоритм составления названий карбоновых кислот:
1. Найдите главную углеродную цепь — это самая длинная цепь атомов углерода, включающая атом углерода карбоксильной группы.
2. Пронумеруйте атомы углерода в главной цепи, начиная с атома углерода карбоксильной группы.
3. Назовите соединение по алгоритму для углеводородов.
4. В конце названия допишите суффикс «-ов», окончание «-ая» и слово «кислота».
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
Для непредельных карбоновых кислот характерна изомерия углеродного скелета, положения кратной связи и межклассовая изомерия.
1.1.2. Химические и физические свойства карбоновых кислот.
Первые три кислоты гомологического ряда (муравьиная, уксусная, пропионовая) — жидкости, хорошо растворимые в воде. Следующие представители — маслянистые жидкости, слабо растворимые в воде. Кислоты, начиная с каприновой С9Н19СООН, — твердые вещества, нерастворимые в воде, но растворимые в спирте, эфире.
Все жидкие кислоты отличаются своеобразным запахами.
Высокомолекулярные твердые кислоты запаха не имеют. С увеличением молекулярной массы кислот повышается их температура кипения и уменьшается плотность.
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты [3].
Ø Кислотные свойства
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты. Из-за высокой полярности связи O-H карбоновые кислоты в водном растворе заметно диссоциируют (точнее, обратимо с ней реагируют):
HCOOH 

Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко замещается водород у третичного, чуть сложнее — у вторичного, и значительно сложнее — у первичного атома углерода.
Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе. Поэтому самая слабая из трех кислот — уксусная, чуть сильнее — хлоруксусная, за ней — дихлоруксусная и самая сильная — трихлоруксусная.
Ø Особые свойства муравьиной кислоты
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала:
CН3 НСООН + Аg2О → 2Аg + СО2 + Н2О
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду
Все органические вещества при горении распадаются на воду и углекислый газ:
CH3COOH + 2O2 
Ø Этерификация (реакция карбоновых кислот со спиртами, приводящая к образованию сложного эфира):
Таблица №1 (химические свойства).
Выделяется водород, образуются соли
Образуются соль и вода
С основаниями (нейтрализация)
Образуются соль и вода
Выделяются углекислый газ и вода
С солями слабых кислот
Образуется неорганическая кислота
С аммиаком или гидроксидом аммония
Образуется ацетат аммония. При взаимодействии с гидроксидом выделяется вода
Карбоновые кислоты меняют окраску индикаторов:
Рис. 1. Изменение окраски индикатора.
1.1.3. Получение карбоновых кислот.
Существует несколько способов получения карбоновых кислот:
Ø окисление спиртов – C2H5OH + O2 → CH3COOH + H2O (из этанола образуется уксусная кислота);
Ø окисление альдегидов – CH3COH + [O] → CH3COOH;
Ø карбонилирование спирта – CH3 + CO → CH3COOH;
Ø разложение щавелевой кислоты для получения муравьиной кислоты – C2H2O4 → HCOOH + CO2;
Ø взаимодействие солей с концентрированной серной кислотой – CH3COONa + H2SO4 → CH3COOH + NaHSO4 [4]
1.2 Характеристика лимонной кислоты
Формула лимонной кислоты:
Физические свойства лимонной кислоты.
- Кислая на вкус
- Твердая, кристалловидная белого цвета
- Хорошо растворима в воде, растворима в этиловом спирте, малорастворима в диэтиловом эфире
- Температура плавления 153°C
- Температура разложения = 175 °C.
- Молярная масса составляет 192,1 г/моль. Плотность — 1,665 г/см³
- Слабая кислота
Химические свойства лимонной кислоты
- Под действие серной кислоты лимонная кислота как α-гидроксикислота разлагается с образованием ацетондикарбоновой и муравьиной кислот.
- Взаимодействует с металлами
- Взаимодействует с основными оксидами
- Взаимодействует с основаниями
- Взаимодействует с солями
- Взаимодействует с аммиаком
- Подвергается электролитической диссоциации
- Проявляет общие для всех карбоновых кислот свойства. При нагревании выше 175 °C лимонная кислота переходит в аконитовую кислоту
- Лимонная кислота переходит в ангидриды итаконовой и цитраконовой кислот (теряется вода и углекислый газ и образование ацетона)
- В реакциях с сильными окислителями (перманганат калия, бертолетова соль) переходит в акриловую кислоту и этиленоксид .
- В водном растворе образует хелатные комплексы с ионами кальция , магния , меди , железа и др [5].
1.2.1. Получение лимонной кислоты в промышленности.
Около 60 лет назад лимонную кислоту выделяли преимущественно из плодов цитрусовых растений. В настоящее время основной путь промышленного производства — биосинтез из сахара или сахаристых веществ ( меласса ) промышленными штаммами плесневого гриба Aspergillus niger . Поскольку основным сырьем для получения лимонной кислоты является меласса, в которой содержится много железа, то на стадии пред-ферментации его осаждают при помощи желтой кровяной соли -K4[Fe(CN)6]. Известны два способа ферментации Aspergillus niger — поверхностный и глубинный. Первый из них реализуют на предприятиях малой и средней мощности в виде жидкофазной ферментации на жидкой среде (например, в ряде стран Европы и Америки) и в виде твердофазной ферментации (например, в Японии). Ныне Е330 получают новыми способами[6]. Среди них самыми популярными являются:
- с помощью плесневых грибов;
- из продуктов получения сахара;
- синтезирование.
Нахождение лимонной кислоты в природе.
Лимонная кислота в определённой концентрации содержится в большинстве прокариотов и почти во всех эукариотах (преимущественно в митохондриях).
В естественном виде лимонную кислоту содержат такие фрукты и ягоды, как: земляника, все цитрусовые, крыжовник, брусника, персики, лимоны в большом количестве (особенно несозревшие), ананасы, барбарис, хвойные, рябина, помидоры, клюква, абрикосы, гранаты, черная смородина, айва, вишня, китайский лимонник, малина, сливы, махорка и другие.
1.2.2. Особенные свойства лимонной кислоты и ее солей.
Лимонная кислота всегда есть в человеческом организме. Ее производные — соли, выполняют важную роль при формировании костей, помогая регулировать размер кристаллов кальция. В биохимии соли данной кислоты имеют большое значение в качестве промежуточного звена в цикле трикарбоновых кислот, который имеет место при метаболизме у всех аэробных организмов. Обладает лимонная кислота и ценными лечебными свойствами. Она способствует очищению организма от вредных веществ, лишних солей, шлаков, положительно влияет на работу систем пищеварения, улучшает зрение, сжигает углеводы, проявляет ценные противоопухолевые свойства, повышает иммунитет. Лимонная кислота также способствует выведению токсинов через клетки кожи [7] .
С другой стороны, сухая лимонная кислота и её концентрированные растворы при попадании в глаза вызывают сильное раздражение, при контакте с кожей возможно слабое раздражение. При употреблении внутрь больших количеств лимонной кислоты возможны: раздражение слизистой оболочки желудка, кашель, боль, кровавая рвота. При вдыхании пыли сухой лимонной кислоты — раздражение дыхательных путей. Высокая концентрация данного вещества, применяемая наружу или внутрь, является причиной серьезных ожогов. Также лимонная кислота является разрушителем зубной эмали, вступая с ней в реакцию из-за нейтрализации кальция. Страдающим желудочно-кишечными заболеваниями не рекомендуется (а в некоторых случаях даже запрещено) употреблять продукты, имеющие в своем составе Е330. Также ограничить их употребление или исключить из своего меню следует лицам с повышенной кислотностью, так как поступление в организм лимонной кислоты вызовет ухудшения состояния здоровья, может стать причиной сильных желудочных болей.
1.2.3. Применение лимонной кислоты.
- В кондитерской промышленности лимонная кислота используется как подкислитель и усилитель вкуса.
- В алкогольные и прохладительные газированные и негазированные напитки лимонная кислота добавляется для придания им ощущения свежести.
- Кроме того, она является синергистом, т. е. веществом, усиливающим действие антиоксидантов, таких, например, как аскорбиновая кислота.
- В консервной промышленности лимонная кислота используется как консервант вместо уксуса, который признан канцерогеном и применение которого в большинстве стран в пищевой промышленности резко ограничен.
- В масложировой промышленности лимонная кислота предохраняет продукцию от разлагающего действия находящихся в них следов тяжелых металлов, путем образования с ними комплексных соединений. Таким путем значительно снижается вероятность прогоркания жиров, маргаринов и животного масла.
- Применяется в медицине, в том числе в составе средств, улучшающих энергетический обмен (в цикле Кребса ).
- В косметике используется как регулятор кислотности , буфер , хелатирующий агент , для шипучих композиций (ванны).
- Применение в домашнем хозяйстве :
- Для продления времени стояния роз в воде, ее нужно обогатить сахаром и лимонной кислотой. Для вазы, в которую помещается пять литров воды нужно взять 1 г лимонной кислоты (1/8 чайной ложки) и стакан сахара, растворить в воде и поместить в этот раствор розы.
- Раствор для очищения утюга от накипи. Такой способ очистки применим для утюгов с возможностью подачи пара. Чтобы приготовить чистящий раствор, в стакане воды следует растворить столовую ложку лимонной кислоты. Этот раствор залить вместо воды в резервуар для подачи пара, подключить утюг к сети электропитания, установить отметку подачи пара на максимум и нажимая на кнопку подачи пара, постепенно очищать утюг. По окончанию проведения этой процедуры в резервуар для воды наливают чистую воду и повторяют процедуру несколько раз, с целью очистки парообразующих путей от следов лимонной кислоты.
- Раствор для очищения налет или потемнений на посуде из серебра, а также ювелирных украшениях, любые монеты, кулоны, перстни, браслеты и так далее [8].
- Раствор для очищения накипи на дне и стенках чайника. Очистить сантехнику и даже стены ванной комнаты можно при помощи порошка, полученного из Е 330. Желательно, чтобы фракции порошка были мелкими, а достигнуть этого можно, размолов средство в кофемолке (используя средства защиты дыхательных путей) или хотя бы измельчив скалкой на столе. Использовать так само, как и все чистящие порошки — нанеся небольшое количество на губку, постепенно очищать поверхность.
- Обладая легкими дезинфицирующими свойствами, Е 330 прекрасно подходит для очищения кухонных столов. Протирать стол слабым раствором этого вещества достаточно раз в неделю [9].
Глава 2. Материал и методика исследования
1. «Растворение лимонной кислоты в воде, определение ph среды раствора».
В стакан с водой насыпаем 5 грамм лимонной кислоты, перемешиваем. Делаем выводы о растворимости лимонной кислоты. Несколько капель раствора лимонной кислоты капаем на универсальную индикаторную бумагу. Отмечаем изменение цвета. Сравниваем цвет с эталонной шкалой ph .
2. «Взаимодействие раствора лимонной кислоты с металлами»
В пробирку присыпаем стружку магния и приливаем 2 мл раствора лимонной кислоты. Отмечаем признаки реакции.
3. «Взаимодействие раствора лимонной кислоты с оксидами металлов»
В пробирку насыпаем немного порошка оксида меди и приливаем раствор лимонной кислоты. Пробирку подогреваем. Отмечаем признаки химической реакции.
4.«Взаимодействие раствора лимонной кислоты с щелочью»
В пробирку приливаем раствор гидроксида натрия, добавляем несколько капель фенолфталеина. Отмечаем изменение окраски раствора. Приливаем в пробирку 2 мл раствор лимонной кислоты. Отмечаем изменение цвета раствора щелочи.
5.«Взаимодействие раствора лимонной кислоты с солями»
В пробирку добавляем несколько грамм порошка карбоната кальция и приливаем раствор лимонной кислоты. Отмечаем признаки химической реакции.
6. «Взаимодействие раствора лимонной кислоты с пищевой содой»
В стакан с водой насыпаем 3 грамма пищевой соды, размешивает до растворения. В пробирку приливаем 2 мл раствора лимонной кислоты, затем 2 мл раствора питьевой соды. Отмечаем признак реакции.
7. «Выявление биологической роли лимонной кислоты».
Разрезаем яблоко пополам. На одну половинку яблока наносим раствор лимонной кислоты, а вторую половинки оставляем непропитанной. Наблюдаю, что через некоторое время те половинки, которые не были смазаны раствором, темнеют.
8. «Осаждение белков молока лимонной кислотой».
В стакан с молоком насыпаем немного кристаллов лимонной кислоты. Перемешиваем, отмечаем появившийся творожистовидный осадок.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://infourok.ru/izuchenie-svojstv-karbonovyh-kislot-na-primere-limonnoj-kisloty-5285477.html http://acetyl.ru/o/a51k3i3r15ka11k.php |