Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e01af76bc81fa34 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Отношение цинка, кадмия и ртути к разбавленным и концентрированным кислотам
Задача 1021.
Сравнить отношение цинка, кадмия и ртути к разбавленным и концентрированным кислотам: а) соляной; б) серной; в) азотной. Написать уравнения соответствующих реакций.
Решение:
Цинк, кадмий и ртуть – металлы, образующие подгруппу цинка. Активность их понижается от Zn к Hg. Цинк – амфотерен: легко растворяется в кислотах, а при нагревании – в щелочах. Кадмий в щелочах не растворяется, а в кислотах -менее энергично, чем цинк. Ртуть взаимодействует только с кислотами, которые являются сильными окислителями.
Отношение цинка, кадмия и ртути к разбавленным и концентрированным кислотам:
а) Отношение цинка, кадмия и ртути к соляной кислоте.
Соляная кислота взаимодействует с металлами, стоящими в электрохимическом ряду металлов до водорода с образованием соли и выделением газообразного водорода:
1) Цинк легко растворяется в соляной кислоте:
2) Кадмий значительно хуже, чем цинк растворяется в соляной кислоте:
3) Ртуть не растворяется в соляной кислоте, она растворяется в царской водке:
б) Отношение цинка, кадмия и ртути к серной кислоте.
1) Взаимодействие серной кислоты с металлами проходит различно в зависимости от её концентрации. Разбавленная серная кислота окисляет своим ионом водорода. Из-за этого она взаимодействует только с теми металлами, которые стоят в ряду напряжений до водорода, например Zn и Cd:
Ртуть не взаимодействует с разбавленной серной кислотой (в ряду напряжений металлов ртуть находится после водорода; нормальный потенциал Hg / Hg 2+ = +0,85 B).
2) Концентрированная серная кислота является окислителем за счёт серы. Она окисляет металлы, стоящие в ряду напряжений до серебра включительно. Продукты её восстановления могут быть различными в зависимости от активности металла и от условий (концентрация кислоты, температура).
При взаимодействии серной кислоты с более активными металлами продуктами восстановления могут быть как SO2, так и свободная сера и сероводород. Так, при взаимодействии с цинком могут протекать реакции:
Взаимодействие серной кислоты с кадмием протекает труднее, чем с цинком:
3Cd + 4 H 2 SO 4 = 3 ZnSO 4 + S + 4H2O
При растворении ртути в горячей концентрированной серной кислоте в зависимости от избытка ртути или кислоты образуются соли одновалентной или двухвалентной ртути:
а) Отношение цинка, кадмия и ртути к азотной кислоте.
C металлами, стоящими в ряду напряжений левее водорода азотная кислота реагирует по разному в зависимости от концентрации, например с цинком и кадмием:
3Zn + 8HNO3(30%) = 3 Zn(NO 3 ) 2 + 2NO ↑ + 4H 2 O
Реакции азотной кислоты с кадмием протекают аналогично, как и с цинком только труднее.
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
увеличение концентрации кислоты ← NO2, NO, N2O, N2, NH4NO3 → увеличение активности металла.
При растворении ртути в разбавленной азотной кислоте образуется нитрат ртути (II):
При избытке ртути образуется нитрат ртути (I):
Ртуть легко растворяется в концентрированной азотной кислоте – образуется нитрат ртути (II):
Ртуть (Hg)
Ртуть для очистки золота использовали еще древние греки и римляне. Чистую ртуть впервые в 1735 году выделил швед Георг Брандт, ее принадлежность к металлам была доказана М. В. Ломоносовым в 1759 году, когда российский ученый совместно с Брауном заморозил ртуть и установил ее металлические свойства.
Ртуть является единственным металлом, который находится в жидком состоянии при нормальных условиях.
Ртуть относится к группе редкоземельных металлов (содержание ртути в земной коре 7·10 -6 %), однако, несмотря на это, ртутные руды бывают достаточно концентрированными (до 2,5%) по причине слабого связывания этого металла с другими элементами. 99,98% всей природной ртути находится в рассеянной форме, и только 0,02% — в месторождениях. Современная наука знает порядка 30 ртутьсодержащих минералов, основным из которых является кноварь HgS.
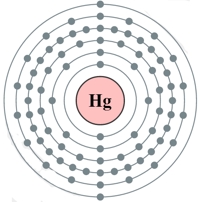
Рис. Строение атома ртути.
Электронная конфигурация атома ртути — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 6s 2 (см. Электронная структура атомов). Как и у цинка, предпоследний электронный слой атома ртути полностью заполнен, а на внешнем слое находится два s-электрона. Однако, в отличие от цинка, ртуть в соединениях может проявлять степень окисления не только +2, но и +1.
| II | I |
| HgO | Hg2O |
| HgCl2 | Hg2Cl2 |
| Hg(NO2)2 | Hg2(NO2)2 |
Ртуть является чрезвычайно токсичным веществом, может вызывать сильное отравление, поскольку, попадая внутрь организма человека вызывает агглютинацию эритроцитов и ингибирование ферментов, что объясняется реагированием ртути с сульфидными группами -SH, которые входят в состав различных белков, аминокислот и ферментов.
Физические свойства ртути:
- при н. у. жидкий металл серебристо-серого цвета;
- диамагнетик;
- со многими металлами образует сплавы, называемые амальгамой.
Химические свойства ртути:
- реагирует с простыми веществами: кислородом, серой, селеном, теллуром, галогенами: 2Hg + O2 = 2HgO; Hg + S = HgS;
- не взаимодействует с N2, P2, Si2, C2;
- реагирует при нагревании с «царской водкой», азотной, концентрированной серной кислотой, образуя нитрат ртути (II):
Hg + 4HNO3(кнц.) = Hg(NO3)2 + 2NO2 + 2H2O; - без нагревания реагирует с азотной кислотой, образуя нитрат ртути (I): 6Hg + 8HNO3(рзб.) = 3Hg2(NO3)2 + 2NO + 4H2O;
- не реагирует со щелочами, разбавленной серной и хлористоводородной кислотами.
Получение ртути:
- чистую ртуть получают электрохимическим рафинированием;
- промышленным способом ртуть получают обжигом руды HgS при высокой температуре (700°C): HgS + O2 = Hg + SO2.
Применение ртути:
- в барометрах, манометрах, термометрах, вакуумных насосах и проч.;
- в ртутных лампах, выпрямителях, переключателях;
- для амальгамации серебра и золота в металлургических процессах;
- в качестве жидкого катода при производстве едких щелочей;
- как катализатор в реакциях синтеза уксусной кислоты;
- как компонент краски морских судов;
- в качестве протравителя семян и гербицида в сельском хозяйстве.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
http://buzani.ru/zadachi/khimiya-glinka/1339-reaktsii-kislot-s-kadmiem-tsinkom-i-rtutyu-zadacha-1021
http://prosto-o-slognom.ru/chimia/515_rtut_Hg.html