Тепловой эффект химической реакции. Термохимические уравнения
Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения . Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Ответ: выделится 740 кДж теплоты.
Характеристики эндотермических реакций, уравнения и примеры
эндотермическая реакция это то, что должно иметь место для поглощения энергии в форме тепла или излучения из окружающей среды. Как правило, хотя и не всегда, их можно узнать по падению температуры в окружающей среде; или наоборот, они нуждаются в источнике тепла, подобном тому, который получен горящим пламенем.
Поглощение энергии или тепла — это то, что объединяет все эндотермические реакции; Природа того же самого, а также связанные с ним преобразования весьма разнообразны. Сколько тепла они должны поглощать? Ответ зависит от его термодинамики: температура, при которой реакция происходит самопроизвольно.
Например, одной из наиболее характерных эндотермических реакций является изменение состояния со льда на жидкую воду. Лед должен поглощать тепло, пока его температура не достигнет приблизительно 0ºC; при этой температуре его таяние становится самопроизвольным, и лед будет поглощать, пока он полностью не растает.
В жарких местах, например на берегах пляжа, температура выше, и поэтому лед быстрее поглощает тепло; то есть он плавится с большей скоростью. Таяние ледников является примером нежелательной эндотермической реакции.
Почему так происходит? Почему лед не может быть представлен как горячее тело? Ответ заключается в средней кинетической энергии молекул воды в обоих состояниях и в том, как они взаимодействуют друг с другом через свои водородные связи..
В жидкой воде ее молекулы имеют большую свободу движения, чем во льду, где они колеблются в своих кристаллах. Чтобы двигаться, молекулы должны поглощать энергию таким образом, что их вибрации разрушают сильные направленные водородные мосты во льду.
По этой причине лед поглощает тепло для таяния. Чтобы был «горячий лед», водородные мостики должны быть аномально прочными, чтобы таять при температуре значительно выше 0 ° C..
- 1 Характеристики эндотермической реакции
- 1,1 ΔH> 0
- 1.2 Охладите свое окружение
- 2 уравнения
- 3 Примеры распространенных эндотермических реакций
- 3.1 Испарение сухого льда
- 3.2 Выпечка хлеба или приготовление пищи
- 3.3 загорать
- 3.4 Реакция атмосферного азота и образования озона
- 3.5 Электролиз воды
- 3.6 Фотосинтез
- 3.7 Растворы некоторых солей
- 3.8. Термические разложения.
- 3.9 Хлорид аммония в воде
- 3.10 Триосульфат натрия
- 3.11 Автомобильные двигатели
- 3.12 кипящие жидкости
- 3.13 Приготовление яйца
- 3.14 Приготовление пищи
- 3.15 Подогрев пищи в микроволновке
- 3.16 Литье стекла
- 3.17 Расход свечи
- 3.18 Чистка горячей водой
- 3.19 Тепловая стерилизация продуктов питания и других предметов
- 3.20 Борьба с инфекциями с лихорадкой
- 3.21 Испарение воды
- 4 Ссылки
Характеристики эндотермической реакции
Изменение состояния не является химической реакцией; однако происходит то же самое: продукт (жидкая вода) имеет больше энергии, чем реагент (лед). Это главная характеристика реакции или эндотермического процесса: продукты более энергичны, чем реагенты.
Хотя это правда, это не значит, что продукты обязательно должны быть нестабильными. В этом случае эндотермическая реакция перестает быть самопроизвольной при всех условиях температуры или давления.
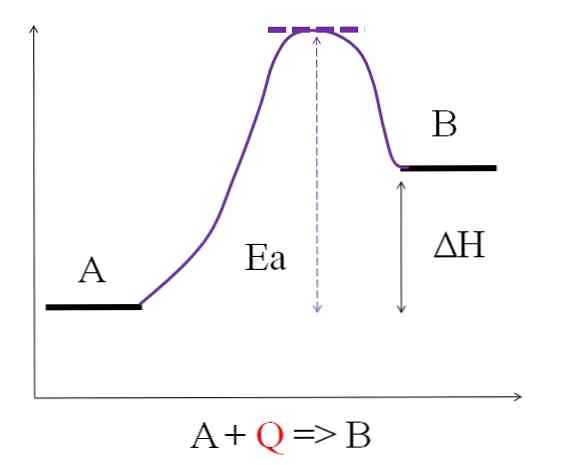
Рассмотрим следующее химическое уравнение:
Где Q представляет тепло, обычно выражаемое в единицах джоуля (Дж) или калорий (кал). Поскольку А поглощает тепло Q для превращения в В, тогда говорят, что это эндотермическая реакция. Таким образом, B имеет больше энергии, чем A, и должен поглощать достаточно энергии для достижения своего преобразования.
Как видно на диаграмме выше, A имеет меньше энергии, чем B. Количество тепла Q, которое поглощает A, таково, что оно преодолевает энергию активации (энергию, необходимую для достижения фиолетового верха с пунктирной крышей). Разность энергий между A и B — это то, что известно как энтальпия реакции, ΔH.
ΔH> 0
Все эндотермические реакции имеют общую предыдущую диаграмму, поскольку продукты более энергичны, чем реагенты. Следовательно, разность энергий между ними, ΔH, всегда положительна (Hпродукт-Hреагент > 0). Когда это правда, должно быть поглощение тепла или энергии из окружающей среды, чтобы удовлетворить эту энергетическую потребность.
И как такие выражения интерпретируются? В химической реакции связи всегда нарушаются, чтобы создать других. Чтобы сломать их, необходимо поглощение энергии; это эндотермический пассаж. Между тем, формирование связей подразумевает стабильность, поэтому это экзотермический шаг.
Когда образовавшиеся связи не обеспечивают стабильность, сравнимую с количеством энергии, необходимой для разрыва старых связей, это эндотермическая реакция. Вот почему необходима дополнительная энергия, чтобы способствовать разрыву наиболее стабильных связей в реагентах..
С другой стороны, в экзотермических реакциях происходит обратное: выделяется тепло, а ΔH cC + dD
Где А и В являются реагентами, а С и D — продуктами. Строчные буквы (a, b, c и d) являются стехиометрическими коэффициентами. Для расчета ΔH этой общей реакции применяется следующее математическое выражение:
Вы можете продолжить напрямую или сделать расчеты отдельно. Для ΔHпроизводить следующая сумма должна быть рассчитана:
Где ΔHF это энтальпия образования каждого вещества, участвующего в реакции. По общему правилу вещества в их наиболее стабильных формах имеют ΔHF= 0 Например, молекулы О2 и H2, или твердый металл, они имеют ΔHF= 0.
Тот же самый расчет теперь сделан для реагентов, ΔHреагенты:
Но, как видно из уравнения, ΔHреагенты должен быть вычтен из ΔHпроизводить, тогда предыдущая сумма должна быть умножена на -1. Итак, у вас есть:
Если результатом этого расчета является положительное число, то это эндотермическая реакция. И если это отрицательно, это экзотермическая реакция.
Примеры распространенных эндотермических реакций
Испарение сухого льда
Кто бы ни видел эти белые пары, исходящие из тележки с мороженым, был свидетелем одного из наиболее распространенных примеров эндотермической «реакции»..
Помимо нескольких видов мороженого, эти пары, отделенные от твердого белого цвета, называемого сухим льдом, также были частью сценариев создания эффекта дымки. Этот сухой лед — не что иное как твердый углекислый газ, который поглощает температуру и прежде, чем внешнее давление начинает сублимировать.
Эксперимент для детской аудитории состоял бы в том, чтобы наполнить и запечатать мешок сухим льдом. Через некоторое время он будет раздуваться из-за СО2 газообразный, создающий работу или прижимающий внутренние стенки мешка к атмосферному давлению.
Выпечка хлеба или приготовление пищи
Выпекание хлеба является примером химической реакции, так как в настоящее время происходят химические изменения из-за жары. Тот, кто пахнет ароматом свежеиспеченного хлеба, знает, что происходит эндотермическая реакция.
Тесто и все его ингредиенты нуждаются в тепле духовки, чтобы осуществить все преобразования, которые необходимы, чтобы стать хлебом и продемонстрировать его типичные характеристики..
Помимо хлеба на кухне полно примеров эндотермических реакций. Кто готовит, имеет дело с ними ежедневно. Приготовление пасты, размягчение зерна, разогрев зерна кукурузы, выпечка яиц, приправа мяса, выпечка торта, приготовление чая, разогрев бутербродов; каждая из этих активностей является эндотермическими реакциями.
Загорать
Какими бы простыми и распространенными они ни казались, солнечные ванны, которые принимают некоторые рептилии, такие как черепахи и крокодилы, попадают в категорию эндотермических реакций. Черепахи поглощают тепло солнца, чтобы регулировать температуру своего организма..
Без солнца они сохраняют тепло воды, чтобы сохранять тепло; что в итоге охлаждает воду в ваших аквариумах или аквариумах.
Реакция образования атмосферного азота и озона
Воздух в основном состоит из азота и кислорода. Во время грозы выделяется энергия, которая может разрушить прочные связи, которые удерживают атомы азота вместе в N-молекуле.2:
С другой стороны, кислород может поглощать ультрафиолетовое излучение, превращаясь в озон; аллотроп кислорода, который очень полезен в стратосфере, но вреден для жизни на уровне земли. Реакция такова:
Где V означает ультрафиолетовое излучение. Механизм этого простого уравнения очень сложен.
Вода электролизная
Электролиз использует электрическую энергию для разделения молекулы на ее элементы или формирования молекул. Например, при электролизе воды образуются два газа: водород и кислород, каждый в разных электродах:
Также хлорид натрия может страдать от этой же реакции:
На одном электроде вы увидите образование металлического натрия, а на другом — зеленоватые пузырьки хлора.
фотосинтез
Растения и деревья должны поглощать солнечный свет в качестве источника энергии для синтеза своих биоматериалов. Для этого он использует CO в качестве сырья2 и вода, которая в результате длинной серии этапов превращается в глюкозу и другие сахара. Кроме того, образуется кислород, который выделяется из листьев.
Растворы некоторых солей
Если хлорид натрия растворяется в воде, заметных изменений внешней температуры сосуда или контейнера не будет..
Некоторые соли, такие как хлорид кальция, CaCl2, повышение температуры воды как продукта большой гидратации ионов Ca 2+ . И другие соли, такие как нитрат или хлорид аммония, NH4НЕТ3 и NH4Cl, понизить температуру воды и охладить ее окрестности.
В классных комнатах обычно проводят домашние эксперименты, растворяя некоторые из этих солей, чтобы продемонстрировать, что является эндотермической реакцией..
Снижение температуры происходит из-за гидратации ионов NH4 + он не благоприятствует растворению кристаллических структур его солей. Следовательно, соли поглощают тепло из воды, что позволяет сольватировать ионы.
Другой химической реакцией, которая обычно очень часто демонстрирует это, является следующее:
Обратите внимание на количество образовавшейся воды. Смешивая оба твердых вещества, получают водный раствор Ba (NO3)2, с запахом аммиака и с таким перепадом температуры, что буквально замерзает внешняя поверхность контейнера.
Термические разложения
Одним из наиболее распространенных термических разложений является бикарбонат натрия, NaHCO3, производить CO2 и вода при нагревании. Многие твердые вещества, включая карбонаты, имеют тенденцию разлагаться с выделением СО2 и соответствующий оксид. Например, разложение карбоната кальция происходит следующим образом:
То же самое происходит с карбонатами магния, стронция и бария.
Важно отметить, что термическое разложение отличается от горения. В первом случае нет воспламенения или выделяется тепло, а во втором да; то есть сгорание является экзотермической реакцией, даже если для этого требуется самопроизвольный источник тепла, который должен происходить или происходить самопроизвольно.
Хлорид аммония в воде
Когда небольшое количество хлорида аммония (NH4Cl) растворяется в воде в пробирке, пробирка становится холоднее, чем раньше. Во время этой химической реакции тепло поглощается из окружающей среды..
Триосульфат натрия
Когда кристаллы тиосульфата натрия (Na2S2О3.5H2О), обычно называемый гипо, растворяется в воде, возникает охлаждающий эффект.
Автомобильные двигатели
Сжигание бензина или дизеля в двигателях легковых, грузовых автомобилей, тракторов или автобусов производит механическую энергию, которая используется в обороте этих транспортных средств..
Кипящие жидкости
Помещая жидкость в тепло, она набирает энергию и переходит в газообразное состояние.
Готовим яйцо
При нагревании яичные белки денатурируются, образуя твердую структуру, которая обычно проглатывается.
Приготовление пищи
В общем, всегда при приготовлении пищи с использованием тепла, чтобы изменить свойства пищи, происходят эндотермические реакции.
Эти реакции — то, что заставляет пищу становиться более мягкой, генерировать податливые массы, выпустить компоненты, которые они содержат, среди прочего.
Подогрев пищи в микроволновке
Под действием микроволнового излучения молекулы воды в пище поглощают энергию, начинают вибрировать и повышают температуру пищи..
Формованное стекло
Поглощение тепла стеклом делает их соединения более гибкими, облегчая изменение их формы.
Расход свечи
Воск свечи тает, поглощая тепло пламени, изменяя свою форму..
Чистка горячей водой
При использовании горячей воды для очистки объектов, загрязненных смазкой, таких как кастрюли или одежда, смазка становится более жидкой и ее легче удалить.
Тепловая стерилизация продуктов питания и других предметов
При нагревании предметов или пищи содержащиеся в них микроорганизмы также повышают свою температуру.
Когда подается много тепла, происходят реакции внутри микробных клеток. Многие из этих реакций, такие как разрыв связей или денатурация белка, в конечном итоге убивают микроорганизмы.
Борьба с инфекциями с лихорадкой
Когда лихорадка проявляется, это происходит потому, что организм производит необходимое тепло, чтобы убить бактерии и вирусы, которые вызывают инфекции и вызывают заболевания.
Если выделяемое тепло высокое, а температура высокая, клетки организма также поражаются и существует риск смерти.
Испарение воды
Когда вода испаряется и превращается в пар, это происходит из-за тепла, которое она получает от окружающей среды. По мере того как тепловая энергия поступает в каждую молекулу воды, ее вибрационная энергия возрастает до такой степени, что она может свободно перемещаться, создавая пары.
Экзотермические и эндотермические реакции.
Химическая реакция заключается в разрыве одних и образовании других связей,поэтому она сопровождается выделением или поглощением энергии в виде теплоты,света, работы расширения образовавшихся газов.
По признаку выделения или поглощения теплоты реакции делятся на экзотермические и эндотермические.
— химическая реакция, при которой происходит выделение теплоты.
Например, в реакции горения метана
выделяется столько теплоты, что метан используется как топливо.
Тот факт, что в этой реакции выделяется теплота, можно отразить в уравненииреакции:
Это так называемое
Здесь символ «+Q» означает,что при сжигании метана выделяется теплота. Эта теплота называется
Термохимическое уравнение реакции
— уравнение реакции, включающее тепловой эффект реакции, рассчитанный на количества вещества, задаваемые коэффициентами этого уравнения.
Эндотермическая реакция — химическая реакция, при которой происходит поглощение теплоты.
Тепловой эффект таких реакций отрицательный.
Наряду с тепловым эффектом термохимические процессы очень часто характеризуют разностью энтальпий ∆H продуктов реакции и исходных веществ.
— это определенное свойство вещества, оно является мерой энергии, накапливаемойвеществом при его образовании.
Процессы, протекающие при постоянном давлении,встречаются гораздо чаще, чем те, которые протекают при постоянном объеме, так как большинство из них проводится в открытых сосудах. Доказано, что в химических процессах, протекающих при постоянном давлении, выделившееся (или поглощенное) тепло есть мера уменьшения (или соответственно увеличения) энтальпии реакции ∆ H.
При экзотермических реакциях , когда тепло выделяется, ∆Н отрицательно. При эндотермических реакциях (тепло поглощается) и ΔH положительно.
Термохимические уравнения.
На первых этапах изучения химии вы часто пользовались равным по абсолютной величине и противоположным по знаку обозначением,например:
где Q — количество выделенной теплоты. Если использовать энтальпию (характеристику энергосодержания системы), то это уравнение следует записать иначе:
В справочных таблицах обычно приводят не значениявеличины Q, а значения величины ∆H, измеренные приопределенных условиях (чаще всего при 298 К); их обозначают ∆H0.
Теплота образования химических соединений.
Теплотой образования соединения называется количество теплоты, которое выделяется или поглощаетсяпри образовании одного моля химического соединения из простых веществ пристандартных условиях (р = 10 5 Па, T = 298 К).
Тепловые эффекты химической реакции. Основные законы термохимии.
Количество теплоты, которое выделяется или поглощается врезультате реакций между определенными количествами реагентов, называют тепловым эффектом химическойреакции и обычно обозначают символом Q.
Она измеряется в кДж/моль. Согласно этому определению , теплота образования простого вещества при стандартныхусловиях равна О.
вещества называется тепловой эффект сгорания 1 моля этого вещества
Изменение энтальпии ∆Н зависит отдавления и температуры. Поэтому для того, чтобы облегчить сравнениетермохимических данных для различных реакций, были приняты определенныестандартные состояния (условия).
При написании термохимических уравнений твердое вещество, жидкость и газобязательно обозначаются символами (тв), (ж) и (г) соответственно, посколькуизменение энтальпии зависит от агрегатного состояния реагирующих веществ ипродуктов реакции.
для газа — состояние чистого газа при 10 5 Па;
для жидкости — состояние чистой жидкости при 10 5 Па;
для твердого вещества — наиболее устойчивое при давлении 10 5 Па кристаллическое состояние, например графит у углерода, ромбическая сера у серы и т. п.
Стандартное состояние всегда относится к 298 К.
Так, например,термохимическое уравнение образования воды из водорода и кислорода записываетсяследующим образом:
Значение 286 кДж является теплотой образования воды встандартных условиях и означает, что при образовании 1 моля воды выделяется 286 кДж теплоты: Отметим, что значение теплоты образования газообразнойводы уже будет иным.
Закон Гесса и его следствия.
Важнейшим законом, на котором основано большинство термохимических расчетов, является закон Гесса (его называют также законом суммы тепловых эффектов).
Тепловой эффект химической реакции зависит от состояния исходных веществ и продуктов реакции, но не зависит от промежуточных стадий реакций.
http://ru.thpanorama.com/articles/qumica/reaccin-endotrmica-caractersticas-ecuaciones-y-ejemplos.html
http://examchemistry.com/content/lesson/himreakcii/teplovoieffekt.html