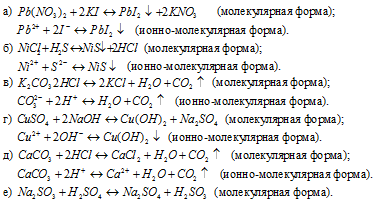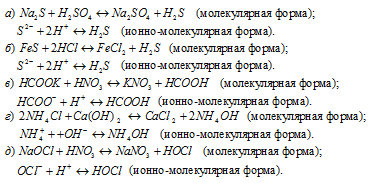Сульфат бария: способы получения и химические свойства
Сульфат бария BaSO4 — соль металла бария и серной кислоты. Белый, тяжелый, при сильном нагревании плавится и разлагается.
Не растворяется в воде. Малореакционноспособный.
Относительная молекулярная масса Mr = 233,39; относительная плотность для тв. и ж. состояния d = 4,5; tпл = 1580º C (разлагается).
Способ получения
1. В результате взаимодействия хлорида бария и сульфата натрия образуется сульфат бария и хлорид натрия:
2. Гидроксид бария вступает в реакцию с разбавленной серной кислотой и образует сульфат бария и воду:
Химические свойства
1. Сульфат бария реагирует с простыми веществами :
1.1. Сульфат бария взаимодействует с углеродом (коксом) при 1100 — 1200º С и образует сульфид бария, угарный газ или углекислый газ:
BaSO4 + 4C = BaS + 4CO
1.2. Хлорид бария вступает в реакцию с водородом при 900 — 1000º С с образованием сульфида бария и воды:
2. Сульфат бария вступает в реакцию со сложными веществами :
2.1. Сульфат бария взаимодействует с оксидами:
2.1.1. Сульфат в результате реакции с угарным газом при 600 — 800º С образует сульфид бария и углекислый газ:
BaSO4 + 4CO = BaS + 4CO2
2.2. Сульфат бария может реагировать с концентрированной серной кислотой. При этом сульфат бария образует гидросульфат бария:
3. Сульфат бария разлагается при температуре выше 1580º С, образуя оксид бария, оксид серы (IV) и кислород:
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e07e5d4888cc85f • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Cоставление ионно-молекулярных форм уравнений реакций
Задача 580.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов: 
Решение:
Так как реакция протекает с образованием сернистой кислоты – слабого электролита и при этом не выпадает осадок и не выделяется газ, то, по условию задачи, ионно-молекулярное уравнение не пишем.
Задача 581.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссoциированных соединений: 
Решение:
Задача 582.
Написать в ионно-молекулярной форме уравнения реакций нейтрализации: 
Указать, какие из этих реакций протекают обратимо, а какие необратимо.
Решение:
а) 2HCl + Ba(OH)2 ⇔ BaCl2 + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H 2 O (ионно-молекулярная форма).
Реакция протекает до конца, так как в реакцию вступают сильные электролиты соляная кислота и гидроксид бария образуется слабый электролит вода.
б) HF + KOH ⇔ KF + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
В реакции участвуют два слабых электролита фтороводород и вода, согласно принципу Ле Шателье, равновесие реакции будет смещено в сторону более слабого электролита, т.е. вправо в сторону образования воды. Реакция обратима.
в) Fe(OH)3 + 3HNO3 ⇔ Fe(NO3)3 + 3H2O (молекулярная форма);
3H + + 3OH — ⇔ 3H2O (ионно-молекулярная форма).
В реакции участвуют слабое малорастворимое основание и сильная кислота, равновесие будет смещено в сторону образования более слабого электролита воды. Реакция будет протекать до конца.
г) CH3COOH + NH4OH ⇔ CH3COONH4 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
д) HNO2 + NH4OH ⇔ NH4NO2 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
е) H2S + 2NH4OH ⇔ (NH4)2S + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита сероводородная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
Таким образом, реакции нейтрализации, в которых участвуют слабые кислоты или основания, — обратимы, т.е. могут протекать как в прямом так и в обратном направлении.
http://gomolog.ru/reshebniki/8-klass/eremin-2019/36/3.html
http://buzani.ru/zadachi/khimiya-glinka/1194-ionno-molekulyarnaya-forma-uravneniya-zadachi-580-582