Уравнение реакции сернистой кислоты с кальцием
Какие свойства проявляет сернистая кислота в окислительно-восстановительных реакциях при взаимодействии с кальцием, сероводородом, иодом? Запишите уравнения возможных реакций и укажите функции сернистой кислоты в них.
`Ca + underset(«окислитель»)(overset(+1)(H)_2SO_3) = CaSO_3 + overset(0)(H)_2″↑»`
`2H_2S + underset(«окислитель»)(H_2overset(+4)(S)O_3) = 3H_2O + 3overset(0)(S)»↓»`
`I_2 + underset(«восстановитель»)(H_2overset(+4)(S)O_3) + H_2O = H_2overset(+6)(S)O_4 + 2HI`
Реакция взаимодействия CaCl2, H2SO4
Одним из камней преткновения на первых шагах изучения химических закономерностей и основ является написание химических реакций. Поэтому вопросы о взаимодействии CaCl2, H2SO4 встречаются даже не периодически, а систематически. Разберем основные «проблемные» моменты.
Запись молекулярного уравнения
Взаимодействие между хлоридом кальция (соль) и серной кислотой протекает по обменному механизму.
- два соединения на входе (исходные вещества);
- два соединения на выходе (продукты);
- полное отсутствие простых веществ.
Обмениваясь друг с другом реакционными группами, реагенты видоизменяются, а уравнение принимает вид:
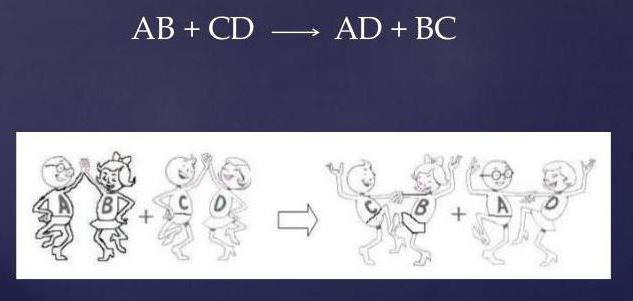
CaCl2 + H2SO4 = CaSO4 + 2HCl.
Как видно, два сложных вещества, меняясь ионами, образуют совершенно иные соединения: новую соль (CaSO4) и соляную кислоту (HCl).
Возможность протекания до конца
Ответить на сей вопрос можно запросто, записав для CaCl2, H2SO4 уравнение реакции в молекулярном виде. От вида продуктов и будет всё зависеть. До конца процесс идет в случае образования:
- труднорастворимого вещества (осадка);
- летучего соединения (газа);
- малодиссоциирущего реагента (воды, слабого электролита).
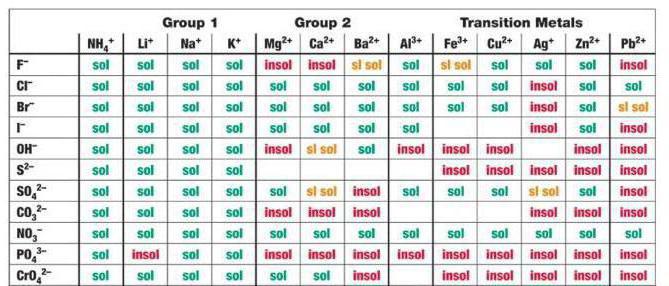
В рассматриваемом для CaCl2, H2SO4 случае среди продуктов реакции имеется сульфат кальция – малорастворимое соединение, выпадающее в осадок, согласно таблице.
Следовательно, обменный процесс пройдет до конца.
Сокращенная ионная форма записи между CaCl2, H2SO4
Расписав все растворимые соединения на ионы и сократив повторяющиеся реакционные группы, получим два искомых уравнения:
- полная ионная форма записи между CaCl2, H2SO4
ca 2+ + 2cl — + 2h + + so4 2- = caso4 + 2h + + 2cl —
- сокращенный вид уравнения
Следует помнить, что на ионы расписываются только растворимые соли, кислоты, основания (это легко определяется по специальным таблицам). Слабые электролиты типа угольной или уксусной кислоты всегда пишутся в молекулярной форме.
Теперь вы знаете, как происходит взаимодействие между хлоридом кальция (соль) и серной кислотой.
Сернистая кислота: строение и химические свойства
Сернистая кислота H2SO3 – это двухосновная кислородсодержащая кислота. При нормальных условиях — неустойчивое вещество, которое распадается на диоксид серы и воду.
Валентность серы в сернистой кислоте равна IV, а степень окисления +4.
Химические свойства
1. Сернистая кислота H2SO3 в водном растворе – двухосновная кислота средней силы. Частично диссоциирует по двум ступеням:
HSO3 – ↔ SO3 2– + H +
2. Сернистая кислота самопроизвольно распадается на диоксид серы и воду:
3. Сернистая кислота взаимодействует с сильными основаниями и их оксидами.
Например , сернистая кислота реагирует с гидроксидами натрия и калия:
4. Наиболее ярко выражены восстановительные свойства сернистой кислоты. При взаимодействии с окислителями степень окисления серы повышается.
Например , сернистая кислота обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистую:
Озон также окисляет сернистую кислоту:
Качественная реакция на сернистую кислоту – обесцвечивание раствора перманганата калия:
5. В присутствии сильных восстановителей сернистая кислота может проявлять окислительные свойства.
Например , при взаимодействии с сероводородом сернистая кислота восстанавливается до молекулярной серы:
http://fb.ru/article/304511/reaktsiya-vzaimodeystviya-cacl-h-so
http://chemege.ru/sernistaya-kislota/