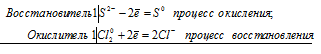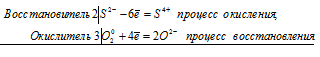Сероводород
Сероводород
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1 о .
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Сероводород: решение задач методом электронного баланса
Подробно решение уравнений окислительно-восстановительных реакций (ОВР) методом электронного баланса разобраны на странице «Метод электронного баланса».
Ниже приведены примеры решения задач ОВР сероводорода (См. Свойства сероводорода).
Если в окислительно-восстановительной реакции принимают участие простые вещества, молекулы которых состоят из двух или более атомов элементов, то в электронном балансе кол-во отданных и полученных электронов определяют с учётом кол-ва атомов в молекуле: H2 0 -2e — → 2H +1 .
Уравнения окислительно-восстановительных реакций сероводорода
1. Уравнение реакции окисления сероводорода при недостатке кислорода с образованием серы и воды:
2. Уравнение реакции окисления сероводорода в избытке кислорода с образованием сернистого ангидрида и воды:
3. Уравнение реакции окисления железа в сероводородной среде с образованием сульфида железа и воды:
4. Уравнение реакции окисления серебра в сероводородной среде с образованием сульфида серебра и воды:
5. Уравнение реакции сероводорода с цинком с образованием сульфида цинка и газообразного водорода:
6. Уравнение реакции сероводорода с сернистым ангидридом с образованием серы и воды:
7. Уравнение реакции сероводорода с концентрированной серной кислотой:
8. Уравнение реакции сероводорода с концентрированной серной кислотой при высокой температуре:
9. Уравнение реакции сероводорода с оксидом железа:
Поскольку часть сульфид-ионов из молекул сероводорода окисляется до серы, а другая — переходит без изменения степени окисления в состав молекул сульфида железа, поэтому, в первую очередь уравнивают коэффициенты перед FeS и S, и только потом ставится коэффициент перед H2S.
10. Уравнение реакции сероводорода с дихроматом калия в кислой среде:
11. Уравнение реакции сероводорода с перманганатом калия:
12. Уравнение реакции сероводорода с хлоридом железа:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Окислительно-восстановительные свойства сероводорода, серной и азотной кислот
Решение задач на составление электронных и молекулярных уравнений реакций
Задание 372
Как проявляет себя сероводород в окислительно-восстановительных реакциях? Почему? Составьте электронные и молекулярные уравнения реакций взаимодействия раствора сероводорода: а) с хлором; б) с кислородом.
Решение:
Поскольку в Н2S атом серы находится в своей низшей степени окисления -2, то сероводород всегда будет являться восстановителем во всех окислительно-восстановительных реакциях. На воздухе он горит, окисляясь до SO2, в растворах медленно окисляется кислородом воздуха до свободной серы. С галогенами сероводород окисляется до свободной серы, со многими другими окислителями образуется свободная сера или сульфат-ион.
Уравнения реакций взаимодействия сероводорода с хлором и кислородом:
а) реакция сероводорода с хлором
Cl2 0 + S 2- = S 6+ + 2Cl —
б) реакция сероводорода с кислородом
3О2 0 + 2S 2- = 2S 4+ + 2О 2-
Задание 375
Какие свойства в окислительно-восстановительных реакциях проявляет серная кислота? Напишите уравнения реакций взаимодействия разбавленной серной кислоты с магнием и концентрированной — с медью. Укажите окислитель и восстановитель.
Решение:
Серная кислота обладает окислительными свойствами, если её концентрация превышает 70%. Только при концентрации больше 70% принято говорить о специфических свойствах H2SO4 как окислителя. Серная кислота проявляет окислительные свойства, потому что атом серы в ней находится в своей высшей степени окисления +6 и может только присоединять электроны, т.е. уменьшать свою степень окисления. Разбавленная серная кислота в реакциях с металлами, стоящими в ряду напряжений металлов левее водорода, взаимодействует с ними с выделением водорода. При этом происходит изменение степени окисления атомов водорода, образующих ион Н + , а не атомов серы. С металлами, стоящими в ряду напряжений правее водорода разбавленная серная кислота не взаимодействует.
Уравнения реакций взаимодействия разбавленной серной кислоты с магнием и концентрированной — с медью
а) взаимодействие разбавленной серной кислоты с магнием
Mg 0 + 2H + = Mg 2+ + H2 0
Магний увеличивает свою степень окисления от 0 до +2, т. е. является восстановителем, а водород окислитель, потому что уменьшает свою степень окисления от +1 до 0.
б) взаимодействие концентрированной серной кислоты с медью
Cu 0 + S 6+ = Cu 2+ + S 4+
Задание 384
Чем существенно отличается действие разбавленной азотной кислоты на металлы от действия хлороводородной (соляной) и разбавленной серной кислот? Что является окислителем в первом случае, что — в двух других? Приведите примеры.
Решение:
Действие разбавленной азотной кислоты на металлы заключается в том, что в HNO3 при этом азот уменьшает свою степень окисления от +5 до +2, +1, 0, -3. Объясняется это тем, что при фиксированной концентрации HNO3 могут быть «атакованы» большим числом электронов. Это приводит к снижению степени окисления азота в продуктах восстановления HNO3. Так, для разбавленной HNO3 имеется два случая, характеризующихся выделением NO, при взаимодействии с тяжёлыми металлами, и N2 при взаимодействии окислителя с активными металлами и получаем промежуточный случай для малоактивных металлов продуктом восстановления HNO3 должен являться N2O. Таким образом, при восстановлении HNO3 (разбавленной) активными металлами(от Mg до Cr) продуктом восстановления является N2, а тяжёлыми металлами (от Sb до Au) – NO. Окислителем является атом азота со степенью окисления +5.
Соляная и разбавленная серная кислота при взаимодействии с металлами, стоящими в электротехническом ряду напряжений левее водорода взаимодействуют так, что выделяется Н2. В этом случае окислителем являются ионы водорода Н+, входящие в состав молекул HCl и H2SO4. Хлор и сера вообще не участвуют в окислительном процессе. С металлами, стоящими в ряду напряжений после водорода, соляная кислота и разбавленная серная кислота не взаимодействует, водород не выделяется.
в) Действие соляной кислоты на металлы:
Таким образом, в разбавленной HNO3 (
http://prosto-o-slognom.ru/chimia_ovr/zadachi_02_H2S.html
http://buzani.ru/zadachi/khimiya-shimanovich/983-svojstva-mineralnykh-kislot-zadaniya-316