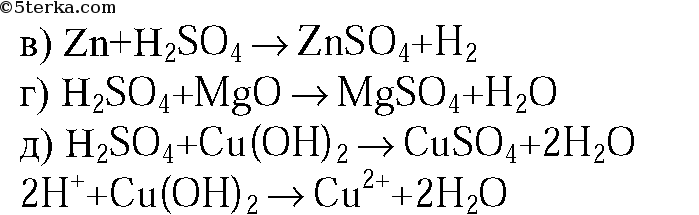Вариант 2
Вопросы:
1. Составьте уравнения реакций: а) серы с углем; б) серы с алюминием (укажите степени окисления атомов и расставьте коэффициенты с помощью метода электронного баланса); в) раствора серной кислоты с цинком; г) раствора серной кислоты с оксидом магния; д) раствора серной кислоты с раствором гидроксида калия (в молекулярной и ионной формах).
2. В каком виде сера встречается в природе? Охарактеризуйте области применения серы.
3. В одной пробирке находится раствор серной кислоты, а в другой — соляная кислота. Как можно распознать эти растворы? Напишите уравнения соответствующих реакций.
Ответы и решения:
2. В природе сера встречается в самородном виде, в составе сульфатов и сульфидов. Основные области применения: для производства серной кислоты, вулканизации каучука, в органическом синтезе.
3. Прилив в обе пробирки раствор хлорида бария, в одной пробирке наблюдает выпадение белого осадка.

задача №2
к главе «Тема II. Подгруппа кислорода. Основные закономерности течения химических реакций. Работа 1. Кислород. Сера. Серная кислота».
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e04e4b018531693 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Уравнение реакции серы и угля
Garage chemist, sciencemadness.org / перевод с английского В.Н. Витер
Четыре года назад, коллега провел несколько экспериментов по синтезу сероуглерода на любительском уровне. Хотя ему и удалось получить очень малое количество продукта, он не смог разработать метод, который позволяет получить существенное количество этого вещества.
Аналогичные результаты были и у автора. Мы нагревали вместе серу и древесный уголь в колбах и ретортах, в надежде получить дистиллят CS2. Единственное, что удалось в результате этого достичь, была испорченная стеклянная посуда.
При взаимодействии парафина или полиэтилена и серы образование CS2 не наблюдалось, происходило только выделение больших количеств H2S.
Проблема состоит в следующем: взаимодействие серы и древесного угля происходит при температуре, которая значительно превышает точку кипения серы, поэтому нагревание смеси сера — древесный уголь в реторте приводит к кипению и испарению серы без какой бы то ни было существенной реакции.
Во-первых, у нас отсутствовал реактор, в котором можно было проводить взаимодействие перегретых паров серы с древесным углем, во-вторых, не было способа нагреть древесный уголь до температуры 900°C, которая необходима для протекания реакции между элементами с достаточно высокой скоростью.
Я понял, что бунзеновская горелка непригодна для нагрева существенного объема реакционной смеси до температуры 900°C.
Несколько бунзеновских горелок, выстроенные в ряд под кварцевой трубкой способны дать температуру 650°C, что было показано в статье, посвященной синтезу кетена.
Ясно, что следует отказаться от установки на основе реторты, в пользу варианта с обогреваемой трубкой. Соответственно для ее нагрева необходима трубчатая печь.
В сотрудничестве с Len1 автору удалось впервые в любительской лаборатории получить существенные количества сероуглерода и поместить материал в интернет.
Для химика-любителя CS2 предоставляет много полезных возможностей, даже если не учитывать, что сам он является хорошим растворителем. В частности, сероуглерод может быть хлорирован до тетрахлорметана, вещества, которое не так просто достать в наше время химику-любителю (в «официальных» лабораториях проблем с CCl4 нет — прим. перев.).
Описанная ниже процедура очень опасна. Сероуглерод — активная, высокотоксичная и очень огнеопасная жидкость с температурой самовоспламенения 100°C. Поскольку синтез проводится при 900°C, любая утечка газов из горячей части аппаратуры приведет к немедленному возгоранию .
Еще большую опасность представляет сероводород, который присутствует как побочный продукт в отходящем газе. Оборудование для конденсации обязательно должно быть расположено под хорошей вытяжкой!
Следует также учитывать, что H2S и CS2 имеют очень неприятный запах.
Реактор представляет собой трубку из плавленого кварца. Внешний диаметр — 26 мм, длина — 1м. На обоих концах трубки находятся шлифы 29/32.
Обратите внимание: при соединении шлифов из кварца и боросиликатного стекла внутренний шлиф должен быть из кварца. В противном случае соединение треснет при нагревании за счет более высокого коэффициента расширения боросиликатного стекла.
Трубка была наполнена измельченным (не порошкообразным) буковым углем. Длина слоя — 50 см. с обоих концов древесный уголь проложен стекловатой. Слой не должен оказывать слишком сильное сопротивление для прохождения воздуха.
Реакционная трубка |
Далее трубка была помещена в трубчатую печь, слева к ней присоединили колбу на 250 мл., в которой было 120 гр. серы. Перед тем как присоединить колбу с серой (к трубке) трубку с углем следует кратковременно нагреть до 800°C, чтобы удалить из угля все летучие вещества. Это очень важно! Древесный уголь содержит большое количество адсорбированной воды. Вода, которая испаряется при нагреве слоя угля, конденсируется на обеих концах трубки. Ее следует обязательно удалить! Для этого оба конца трубки прогревают в пламени бунзеновской горелки до тех пор, пока вся влага внутри не испарятся. Если эту процедуру не проделать, то в процессе синтеза образуется большое количество сероводорода: Эта реакция имеет место уже при 150°C, и равновесие полностью смещено в сторону H2S. Таким образом, предварительное прокаливание угля важно как с позиций безопасной работы, так и для достижения хорошего выхода продукта. Несмотря на все принятые меры, в установке все равно образуется некоторое количество H2S. К правому концу трубки через переходник, изогнутый под углом 45 град., присоединяют трехгорлую колбу на 250 мл. В среднее горло вставляют хороший холодильник, оставшееся горло плотно закрывают пробкой. Отходящие газы из верхней части холодильника направляются под вытяжку, чтобы избавиться от токсичных выбросов (содержат H2S и CS2). Все шлифы были хорошо смазаны. Для охлаждения колбы использовали ведерко с ледяной водой, ледяная вода также циркулировала через холодильник. После того, как были проделаны все вышеописанные операции, температура слоя угля была доведена до 900°C, а серу нагрели с помощью бунзеновской горелки для того, чтобы ее пары начали поступать в трубку. Когда пары серы достигли слоя угля, в правой части установки появился желтый туман. Непрореагировавшая сера конденсировалась на стекловате. На снимке также виден электронный термометр (на основе термопары). Установка в работе: Мы очень обрадовались, увидев, капли почти бесцветной жидкости, которые конденсировались внутри колбы — это и был целевой продукт! Белый туман не дал возможности увидеть, сколько собралось продукта под конец процесса, пока ледяная баня не была удалена. В холодильнике образовывалась лишь небольшое количество конденсата, почти весь продукт конденсировался в колбе (т.е. до холодильника). Процесс был остановлен, когда большая часть серы возогналась в трубку: После удаления ледяной бани мы увидели значительное количество желтоватой жидкости в колбе. Синтез удался! Содержимое было перенесено в колбочку на 100 мл. и перегнано в маленькой дистилляционной установке для удаления растворенной серы. Для охлаждения использовалась вода со льдом. Жидкость почти полностью перегналась при постоянной температуре — 46°C, что позволило ее идентифицировать. Небольшое количество серы осталось в перегонной колбе: Продукт — 44 гр. кристально чистого перегнанного сероуглерода! Несколько капель продукта подожгли. Сероуглерод горел синим пламенем, оставляя на поверхности стекла серу — продукт неполного окисления. Сера, которая осталась в колбе-испарителе, а также в трубке, была взвешена. В результате установлено, что достигнут выход сероуглерода около 50% в пересчете на прореагировавшую серу. Это оставило открытым вопрос: «куда девалась остальная часть серы?». Во время процесса мы на короткое время опускали трубку для отходящих газов (после холодильника) в бутылку с водой, но образование пузырьков почти не наблюдалось. В то же время, в период запуска установки, когда поток паров в трубку был минимален, в бутылке наблюдалось активное образование пузырьков. Было сделано допущение, что именно в этот период значительная часть сероуглерода покинула установку без конденсации. В более позднем эксперименте отходящий газ пропускали (в течение всего синтеза) через ловушку, охлаждаемую смесью льда и соли до температуры минус 20°C. Используемый в предыдущем эксперименте холодильник был отсоединен. В результате в ловушке собралось менее 1 мл. конденсата. Таким образом, эффективность конденсации в приемнике, помещенном в ледяную ванну, составляет 95%. Применение дополнительной охлаждающей ловушки не оправдано. Согласно другой версии, потери серы можно объяснить образованием H2S. В месте, где был размещен выхлоп из вытяжки (а именно — в нашем саду), отмечен сильный запах сероводорода. Видимо, это означает, что в угле даже после прокаливания остается некоторое количество водородсодержащих соединений. В энциклопедии Ульмана (Ullmann’s Encyclopedia) отмечено, что отходящие газы содержат сероводород, это видимо и является основной причиной уменьшения выхода. |
Промышленная печь производства сероуглерода Арндт К. С теми же затруднениями, что и добывание фосфора — с большим расходом реторт, небольшой вместимостью и затруднительностью наблюдения над большим числом их — сталкивалось прежде производство сероуглерода из паров серы и раскаленного угля; поэтому и это производство перешло к пользованию электрическими печами. Рисунок изображает изобретенную Тэйлором печь, с которой работают заводы в Пенн-Ян (Нью-Йорк). Электрода расположены, как и в фосфорных печах, горизонтально в нижней части. Для экономии в электродах последние покрываются, через воронки ММ, измельченным углем, через который ток переходит в реакционную смесь. Уголь всыпается через герметически закрывающийся клапан в крышке печи. Сера помещается в полом пространстве НН, кольцом окружающем печь; она плавится при разогревании печи, стекает на дно F последней, испаряется и поднимается сквозь высокий слой раскаленного угля С, образуя сероуглерод, который отгоняется. Печь имеет в высоту 12 м., в поперечнике 5 м.; она потребляет 4000 ампер при напряжении в 40-60 вольт и дает в 24 часа 5000 кг. сероуглерода. Регулировка температуры происходит автоматически; если она подымается слишком высоко, то в печь стекает слишком много расплавленной серы, последняя покрывает частью электроды; вследствие непроводимости серы сопротивление печи увеличивается, ток ослабляется и температура падает вновь до достижения нормальных условий. Сероуглерод СS2, летучая жидкость, находит широкое применение в технике, несмотря на свою огнеопасность, благодаря способности растворять жиры и каучук. Примечание: современные печи электротермического производства сероуглерода принципиально не отличаются от приведенной конструкции. Наряду с прямым взаимодействием элементов применяется также способ получения сероуглерода с помощью реакции природного газа и серы (см. напр.: А.А. Пеликс и др. Химия и технология сероуглерода. Л., Химия, 1986 [ссылка]). источники: http://gomolog.ru/reshebniki/9-klass/zadachnik-kuznecova-2020/6-10.html http://chemistry-chemists.com/N2_2009/ChemistryAndChemists_2_2009-P1-1.html |