Оксид лития: способы получения и химические свойства
Оксид лития — это белое, гигроскопичное, тугоплавкое вещество, при нагревании не разлагается.
Относительная молекулярная масса = 29,88; относительная плотность для тв. и ж. состояния = 2, 013; tпл = 1453º C; tкип ≈ 2600º C.
Способ получения
1. Оксид лития можно получить путем взаимодействия лития и кислорода :
2. Оксид лития получается при разложении гидроксида лития:
2LiOН → Li2O + Н2O
3. Путем термического разложения карбоната лития с образованием оксида лития и оксида углерода:
4. При термическом разложении нитрата лития образуется оксид лития, оксид азота и кислород:
Химические свойства
1. Литий вытесняется из оксида в результате взаимодействия с другими металлами :
1.1. Оксид лития взаимодействует с металлами и некоторыми неметаллами с образованием лития и оксида металла:
Li2O + Si = 4Li + SiO2
Li2O + Mg = 2Li + MgO
3Li2O + 2Al = 6Li + Al2O3
2. Оксид лития взаимодействует со сложными веществами:
2.1. Оксид лития реагирует с водой . Образуется гидроксид лития:
Li2O + H2O = 2LiOH
2.2. Оксид л ития взаимодействует с кислотами . При этом образуются соль и вода.
Например , оксид лития с соляной кислотой образует хлорид лития и воду:
2.3. При взаимодействии лития с оксидами образуются соли:
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2b03d37f151634 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Оксид лития
| Оксид лития | |
|---|---|
 | |
| Систематическое наименование | Оксид лития |
| Традиционные названия | Окись лития |
| Хим. формула | Li2O |
| Рац. формула | Li2O |
| Состояние | твёрдое |
| Молярная масса | 29,8774 г/моль |
| Плотность | 2,013 г/см³ |
| Температура | |
| • плавления | 1570 [1] |
| • кипения | 2600 [1] °C |
| Растворимость | |
| • в воде | 6,67 (0 °C) |
| Рег. номер CAS | 12057-24-8 |
| PubChem | 166630 |
| Рег. номер EINECS | 235-019-5 |
| SMILES | |
| RTECS | OJ6360000 |
| ChemSpider | 145811 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид лития (окись лития) — бинарное неорганическое вещество, имеющее химическую формулу Li2O. Относится к классу основных оксидов.
Содержание
- 1 Описание
- 2 Получение
- 3 Химические свойства
- 4 Применение
- 5 См. также
Описание
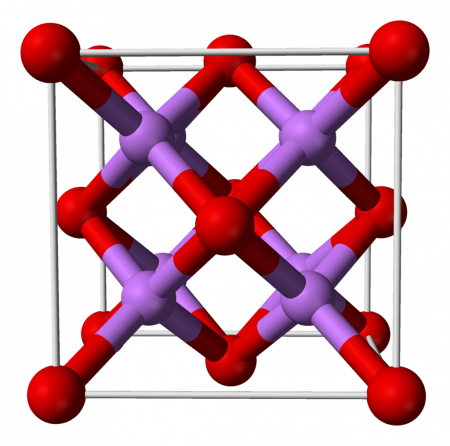
Оксид лития при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы с кубической решёткой. Пространственная группа F m3m, a = 0,4628 нм, Z = 4.
При температуре выше 1000 °C возгоняется, в присутствии паров воды возгонка ускоряется. В газообразном состоянии при температуре выше 1500 °C оксид лития частично диссоциирует на Li и O2. Диамагнитен. С водородом, кислородом, углеродом и монооксидом углерода не взаимодействует даже при нагревании. При высоких температурах реагирует с большинством металлов, за исключением золота, платины и никеля. При действии магния, алюминия или марганца при температуре выше 1000 °C оксид лития восстанавливается до металлического лития. С оксидами ряда металлов дает оксометаллаты, двойные и тройные оксиды. Оксид лития — единственный среди оксидов щелочных металлов, образующийся в качестве основного продукта при нагревании металла выше 200 °C на воздухе (присутствуют только следы пероксида лития). [2]
Получение
- Взаимодействие металлического лития с кислородом:
4 Li + O2 ⟶ 2 Li2O
- Разложение пероксида лития при температуре 195 °C:
2 Li2O2 → 195∘C 2 Li2O + O2↑
Химические свойства
- Взаимодействует с водой, образуя щёлочь:
Li2O + H2O → 2 LiOH
- с кислотами:
Li2O + 2 HCl → 2 LiCl + H2O
- литий из оксида вытесняется некоторыми металлами и неметаллами:
Li2O + Mg → 800∘C 2 Li + MgO 2 Li2O + Si → 1000∘C 4 Li + SiO2
- с кислотообразующими оксидами образует соли:
Li2O + CO2 → 500∘C Li2CO3
Применение
Оксид лития применяют в качестве добавки к смесям реагентов при твердофазном синтезе двойных и тройных оксидов для понижения температуры процесса; как компонент в производстве специальных стёкол (в частности, с небольшим температурным коэффициентом линейного расширения и прозрачных для рентгеновских лучей), глазурей и эмалей, повышающий их химическую и термическую стойкость, прочность и снижающий вязкость расплавов. Также используется в термобарьерных покрытиях вместе с оксидами иттрия и циркония для повышения стойкости.
http://gomolog.ru/reshebniki/8-klass/tetrad-gabrielyan-2020/33/chast-2-zadanie-2.html
http://chem.ru/oksid-litija.html

