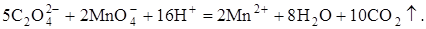СТАНДАРТИЗАЦИЯ РАБОЧЕГО РАСТВОРА
ПЕРМАНГАНАТА КАЛИЯ KMnO4
Перманганат калия обычно содержит ряд примесей, поэтому нельзя считать, что раствор, приготовленный из навески, имеет точную концентрацию, т.е. является стандартным. Кроме того, концентрация перманганата в растворе понижается из-за его взаимодействия с органическими веществами и другими восстановителями, присутствующими в воде.
Раствор перманганата калия должен храниться в склянке из темного стекла, так как под действием света происходит разложение его по реакции:
4 KMnO4 +2 H2O à 4 MnO2 ¯ + 4 KOH + 3O2
Через 5-7 дней после приготовления раствор перманганата калия отфильтровывают через стеклянный фильтр и проводят его стандартизацию.
Молярную концентрацию эквивалента раствора перманганата калия обычно устанавливают по стандартному раствору перекристаллизованного кристаллогидрата щавелевой кислоты Н2С2О4 . 2Н2О.
(.Стандартизация титранта по раствору первичного стандарта.
Задание: стандартизировать титрант — раствор KMnO4.
Цель работы: научиться стандартизировать основной титрант метод перманганатометрии — раствор KMnO4, а именно: получить навыки проведения прямого безындикаторного титрования восстановителей в перманганатометрии; закрепить навыки составления ОВ реакций и расчета молярных масс эквивалентов окислителя и восстановителя; закрепить навыки выполнения расчетов нормальности раствора по результатам прямого титрования.
Реактивы: титрант — раствор KMnO4 (приблизительная концентрация 0,05 н.); раствор первичного стандарта -0,05000 н. Na2C2O4; 1 М H2SO4 — для создания среды.
Посуда: бюретки со стеклянным краном; пипетки Мора; мерный цилиндр для отмеривания раствора H2SO4; колбы для титрования (3 шт.); воронки; дозатор для пипеток или резиновая груша.
Ход выполнения работы
Бюретку наполнить раствором KMnO4, точную концентрацию которого следует установить, и готовить ее к работе, как обычно. Так как раствор KMnO4 имеет темную окраску, то нулевое деление на бюретке и отсчеты объема при титровании следует устанавливать и определять по верхнему краю мениска. В колбу для титрования мерным цилиндром внести 10 мл 1 М раствора H2SO4 и 10,00 мл анализируемого раствора Na2C2O4 (пипетка Мора). Содержимое колбы нагреть на плитке до 80. 90 0 С, т.е. до начала запотевания внутренних стенок колбы для титрования (не кипятить!), и титровать горячую реакционную смесь раствором KMnO4. В начале титрования каждую следующую каплю раствора KMnO4 прибавлять лишь после того, как полностью обесцветится окраска от предыдущей капли. Титрование закончить при появлении бледно-розовой окраски, устойчивой в течение 30 с. Повторять титрование до получения трех сходящихся, т.е. отличающихся друг от друга не более чем на 0,1 мл, результатов.
По результатам титрования рассчитать нормальность раствора KMnO4, как обычно при использовании прямого титрования. Результаты занести в таблицу:
Составить уравнение реакции с использованием электронно-ионного метода, определить фактор эквивалентности окислителя и восстановителя и рассчитать молекулярные массы их эквивалентов. Охарактеризовать условия выполнения титрования.
| Номер титрования | Первичный стандарт Na2C2O4 | Титрант KMnO4 | C(1/2Na2C2O4), моль/л | V(Na2C2O4), мл | V(KMnO4), мл |
| 0,05000 | ||
| 0,05000 | ||
| 0,05000 |
СТАНДАРТИЗАЦИЯ РАСТВОРА ПЕРМАНГАНАТА КАЛИЯ. ПЕРМАНГАНАТОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ПЕРОКСИДА ВОДОРОДА
Задание: стандартизировать титрант — раствор KMnO4.
Цель работы: научиться стандартизировать основной титрант метод перманганатометрии — раствор KMnO4, а именно: получить навыки проведения прямого безындикаторного титрования восстановителей в перманганатометрии; закрепить навыки составления ОВ реакций и расчета молярных масс эквивалентов окислителя и восстановителя; закрепить навыки выполнения расчетов нормальности раствора по результатам прямого титрования.
Реактивы: титрант — раствор KMnO4 (приблизительная концентрация 0,05 н.); раствор первичного стандарта -0,05000 н. Na2C2O4; 1 М H2SO4 — для создания среды, раствор пероксида водорода
Приборы: электроплитки, водяная баня
Посуда: бюретки со стеклянным краном; пипетки Мора; мерный цилиндр для отмеривания раствора H2SO4; колбы для титрования (3 шт.); воронки; дозатор для пипеток или резиновая груша.
1. Стандартизация 0,05 н 1/5KMnO4
Стандартный раствор перманганата калия является вторичным. Приготовление этого раствора имеет ряд особенностей. Свежеприготовленный раствор кипятят в течение 10 минут, а затем выдерживают несколько дней для того, чтобы прошли процессы окисления органических веществ, которые могут содержаться в воде. Образовавшийся осадок MnO2 следует обязательно удалить, так как данное вещество катализирует разрушение перманганата.
4 KMnO4 +2 H2O à 4 MnO2 ¯ + 4 KOH + 3O2
Диоксид марганца отфильтровывают с помощью стеклянного фильтра. Стандартные растворы KMnO4 следует хранить в сосудах тёмного стекла с притёртыми пробками. Стандартизацию растворов следует проводить каждый раз перед применением. В качестве первичного стандарта для стандартизации раствора KMnO4 используют Na2C2O4, H2C2O4×2H2O, Fe, As2O3 и другие вещества. Например:
Реакция взаимодействия между перманганат- и оксалат-ионами, протекает медленно, поэтому её проводят при нагревании (около 70°С). Данная реакция является автокаталитической — роль катализатора выполняют ионы Mn 2+ , образующиеся в ходе реакции.
Cтандартизацию раствора перманганата калия проводят по следующей методике. В 3 колбы для титрования вносят по 10,00 мл 0,05000 М 1/2H2C2O4, прибавляют в каждую колбу по 10 мл 20% (1M) раствора H2SO4, нагревают до температуры примерно 70 °С и медленно титруют стандартизируемым раствором перманганата калия до слабо-розового окрашивания, устойчивого в течение не менее 15 секунд.
Расчёт молярной концентрации 1/5KMnO4 в стандартизируемом растворе проводят по следующей формуле
СТАНДАРТИЗАЦИЯ раствора перманганата калия
Цель работы – установить точную концентрацию раствора KMnO4.
Сущность работы. Точную концентрацию раствора перманганата калия устанавливают через 8–10 дней после его приготовления по щавелевой кислоте H2C2O4∙2H2O, оксалату натрия Na2C2O4 и другим веществам. За это время происходит окисление восстановителей, присутствующих в дистиллированной воде (пыль, следы органических соединений), и концентрация KMnO4 стабилизируется.
Оксалат натрия и щавелевая кислота являются наиболее удобными установочными веществами, так как они не токсичны и устойчивы при хранении.
Титрование оксалат-ионов перманганатом калия проводят в сернокислой среде:
Реакция взаимодействия перманганата калия с оксалат-ионами относится к типу автокаталитических. Она катализируется ионами Mn 2+ . Первые капли KMnO4 даже в горячем растворе обесцвечиваются очень медленно. В ходе титрования концентрация ионов Mn 2+ возрастает и скорость реакции увеличивается.
Лабораторная посуда: бюретка; пипетка Мора; коническая колба для титрования; мерная колба вместимостью 50–100 мл; мерный цилиндр (10–25 мл).
Рассчитывают ориентировочную массу установочного вещества – H2C2O4∙2H2O, необходимую для приготовления 100,0мл 0,05 н. раствора;
Навеску H2C2O4∙2H2O в количестве, отличающемся не более чем на 10 % от расчетного, взвешивают в тигле на технических, а затем на аналитических весах. Навеску аккуратно пересыпают через сухую воронку в мерную колбу и струей дистиллированной воды смывают ее в колбу. Тигель с оставшимися на стенках частицами Н2С2O4×2H2O снова взвешивают на аналитических весах. По разности двух взвешиваний находят массу вещества, перенесенного в колбу:
Заполняют колбу на 2 /3 объема дистиллированной водой. Снимают с колбы воронку и, перемешивая ее содержимое плавными круговыми движениями, добиваются полного растворения щавелевой кислоты. Разбавляют раствор до метки дистиллированной водой и тщательно перемешивают содержимое колбы, многократно перевертывая и встряхивая ее. Вычисляют молярную концентрацию эквивалента щавелевой кислоты С( 1 /2Н2С2O4) с точностью до 4 значащих цифр.
С( 1 /2Н2С2O4) = 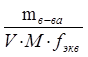
Промывают и заполняют бюретку раствором KMnO4 и устанавливают уровень жидкости на нуле. Отсчеты объема при титровании перманганатом калия целесообразно делать по верхнему краю мениска.
Помещают в коническую колбу для титрования
10 мл 2 н. раствора H2SO4 и нагревают до 80–85 о С. Категорически запрещается кипятить на плитке раствор серной кислоты, так как ее пары имеют резкий неприятный запах. Пипеткой отбирают из мерной колбы аликвотную часть (10мл) раствора Н2С2O4 и вносят в нагретый раствор серной кислоты. Горячий раствор титруют перманганатом калия по каплям, энергично перемешивая. Каждую следующую каплю прибавляют толькопосле того, как исчезнет окраска от предыдущей. Титруют до неисчезающей в течение 30 с слабо-розовой окраски.
Титрование повторяют несколько раз, пока не будет получено не менее трех значений объема титранта, различающихся между собой не более чем на 0,1 мл. Все полученные результаты должны обязательно заноситься в лабораторный журнал, даже если они и одинаковые. Рассчитывают средний объем титранта, учитывая только те значения, которые различаются не более чем на 0,1 мл;
По результатам титрования рассчитывают точную концентрацию раствора перманганата калия:
С( 1 /5KMnO4) = 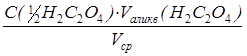
| Студент(ка) |
| Фак-т, курс, № гр. |
Дата выполнения: «___» ___________ 20__ г.
Подпись преподавателя: _________________
Дата защиты: «___» ___________ 20__ г.
Уравнение реакции стандартизации раствора kmno4
Опыт 1. Стандартизация раствора перманганата калия по щавелевой кислоте.
Принцип метода. Титрованный раствор перманганата калия нельзя приготовить из точной навески, т. к. перманганат калия содержит примеси. Кроме того, концентрация этого титранта со временем понижается, т. к. он расходуется на взаимодействие с аммиаком, органическими веществами и другими восстановителями, присутствующими в воде. Поэтому точную концентрацию раствора перманганата калия устанавливают обычно через несколько дней после его приготовления. Исходными веществами для его стандартизации служат свежеперекристаллизованная щавелевая кислота (H2C2O4 · 2H2O) или её соли.
Реакция между оксалат-ионами и перманганат-ионами протекает сложно, и упрощённо может быть представлена уравнением:
5С2O42- + 2MnO4-+ 16H+ ® 2Mn2+ + 8H2O + 10CO2.
5 С2O42- — 2e — ® 2CO2
2 MnO4-+ 8H+ + 5e- ® Mn2+ + 4H2O
В действительности реакция протекает в несколько стадий и для её начала необходимо присутствие катиона марганца (II):
MnO4-+ MnС2O4 ® MnO42-(манганат-ион) + MnС2O4+.
Манганат-ион в кислом растворе быстро диспропорционирует:
А) Mn(VI) + Mn(II) ® 2Mn(IV); б) Mn(IV) + Mn(II) ® 2Mn(III). Марганец (III) образует оксалатные комплексы состава Mn(С2O4)n(3-2n)+, где n=1,2,3; они медленно разлагаются с образованием Mn(II) и CO2. Таким образом, пока в растворе не накопится в достаточных концентрациях марганец (II), реакция между MnO4- и С2O42- протекает очень медленно.
Реагенты и оборудование: раствор перманганата калия (»0,05 н); 2 н раствор серной кислоты; стандартный 0,05 н раствор щавелевой кислоты (Мэ=1/2М(H2C2O4)); бюретка; стеклянная воронка; конические колбы ёмкостью 100 мл; пипетки Мора; стеклянный цилиндр ёмкостью 50 мл; электроплитка.
Ход анализа. В чистую бюретку заливают раствор перманганата калия и подготавливают к титрованию. В коническую колбу для титрования отбирают пипеткой Мора 10,00 мл раствора щавелевой кислоты, прибавляют 10 мл 2 н серной кислоты и нагревают раствор в колбе до 70-80° С (не допуская кипения, при котором щавелевая кислота разлагается) и горячий раствор титруют раствором перманганата калия. Раствор перманганата калия нужно добавлять медленно, по каплям, при непрерывном взбалтывании раствора. Каждую следующую каплю добавляют лишь после того, как обесцветилась предыдущая. Вначале обесцвечивание перманганата калия будет происходить медленно, но по мере образования марганца (II), оно ускорится.
Титрование прекращают, когда избыточная капля перманганата калия сообщит раствору бледную малиновую окраску, не исчезающую в течение 1-2 минут. Отсчёт по бюретке удобно брать по верхнему краю мениска, т. к. нижний плохо виден. Повторяют титрование 2-3 раза.
Обработка результатов. Из сходящихся отсчётов берут средний результат титрования и вычисляют нормальность (Сэ) раствора перманганата калия по формуле:
http://lektsii.org/6-67442.html
http://po-teme.com.ua/khimiya/okislitelno-vosstanovitelnoe-titrovanie/1172-standartizaciya-rastvora-permanganata-kaliya-po-shhavelevoj-kislote.html