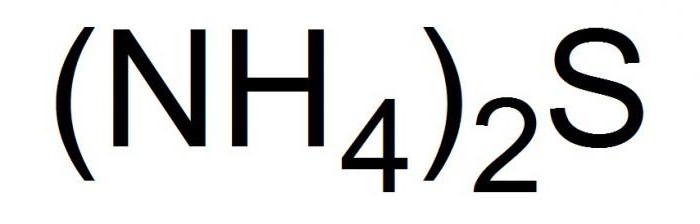Уравнение реакции сульфида аммония с гидроксидом натрия
И с раствором азотной кислоты, и с раствором гидроксида натрия взаимодействует
1) сульфат магния
2) сульфид аммония
4) бромид свинца (II)
Реакции с солями идут до конца при условии наличия признака необратимости реакции обмена: газ, осадок, слабый электролит.
Сульфид аммония при взаимодействии и с кислотой и со щелочью образует слабые электролиты.
Почему не может идти реакции с PbBr2 .
С гидроксидом натрия пойдет с образованием нерастворимого гидроксида свинца, а вот с азотной кислотой — нет разбавленная азотная кислота не окислит бромид свинца.
Напишите уравнения реакций сульфида аммония с кислотой и со щелочью,пожалуйста.
Мне кажется, здесь и четвёртый вариант подходит. С кислотой просто бром будет восстанавливаться, а азот окисляться.
А до куда может окислиться азот в азотной кислоте? )
Но ведь бромид свинца тоже подходит. Свинец амфотерен, а значит и кислота, и щёлочь буду с ним реагировать.
Со щелочью реагировать будет, а вот с азотной кислотой — нет.
Гидроксид натрия: способы получения и химические свойства
Гидроксид натрия (едкий натр) NaOH — белый, гигроскопичный, плавится и кипит без разложения. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 40; относительная плотность для тв. и ж. состояния d = 2,130; tпл = 321º C; tкип = 1390º C;
Способы получения
1. Гидроксид натрия получают электролизом раствора хлорида натрия :
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии натрия, оксида натрия, гидрида натрия и пероксида натрия с водой также образуется гидроксид натрия:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Карбонат натрия при взаимодействии с гидроксидом кальция образует гидроксид натрия:
Качественная реакция
Качественная реакция на гидроксид натрия — окрашивание фенолфталеина в малиновый цвет .
Химические свойства
1. Гидроксид натрия реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
2. Гидроксид натрия реагирует с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
3. Гидроксид натрия реагирует с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
4. С кислыми солями гидроксид натрия также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
5. Гидроксид натрия взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и водорода:
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида натрия:
Сера взаимодействует с гидроксидом натрия только при нагревании:
6. Гидроксид натрия взаимодействует с амфотерными металлами , кроме железа и хрома. При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксид натрия вступает в обменные реакции с растворимыми солями .
Хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с гидроксидом натрия взаимодействуют соли аммония .
Например , при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксид натрия разлагается при нагревании до температуры 600°С:
2NaOH → Na2O + H2O
9. Гидроксид натрия проявляет свойства сильного основания. В воде практически полностью диссоциирует , образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na + + OH —
10. Гидроксид натрия в расплаве подвергается электролизу . При этом на катоде восстанавливается натрий, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Сульфид аммония: получение, гидролиз, применение
Азот — один из важнейших элементов органической химии. В виде сложных соединений элемент N является важной частью белков, из которых состоят все живые организмы на нашей планете. Этот достаточно активный химический элемент образует множество соединений, одним из которых является соединение аммония.
Что это такое
В молекуле аммиака азот охватывает своими ковалентными связями три атома водорода, причем последняя электронная связь остается свободной. Таким образом, аммоний может выступать донором различных химических реакций, образовывая четвертую – незатраченную ковалентную связь с другими веществами и соединениями. Если такое соединение происходит с атомом водорода, образуется молекула NH4. Полученный элемент может реагировать с различными кислотами, которые находятся в растворенном или концентрированном виде. При взаимодействии аммиак их нейтрализует. В итоге реакции получаются соли аммония — термически неустойчивые соединения. Если соль аммония нагревать, она быстро разлагается на составляющие вещества. При повышении температуры образуется аммиак с кислотой. Возможен и обратный процесс. Например, при взаимодействии с сероводородной кислотой можно получить сульфид аммония.
Формула
Это соединение записывается в химических уравнениях в видеследующей формулы.
Распространенные химические реакции
Гидролиз сульфида аммония отличается от других реакций подобных солей тем, что в ней принимают участие и катионы, и анионы одного и того же вещества. Процесс реакции зависит от температуры. Гидролиз сульфида аммония может быть записан следующим образом:
- ионное уравнение гидролиза по катиону:
NH4 + +H2O = NH3*H2O + H+; - уравнение гидролиза по аниону проходит в два этапа:
Итоговое ионное уравнение реакции выглядит следующим образом:
- NH4 + +S2- + 2H2O = NH3*H2O + HS- + H+ + OH-.
Стандартная запись этой химической реакции выглядит так:
Без нагревания реакция может быть обратима и происходит по первой ступени. Но если вещество подогреть, реакция станет необратимой – конечные вещества аммиак и сероводород просто покидают поле взаимодействия и улетучиваются.
Получение сульфида аммония
Сульфид аммония чаще всего получают при взаимодействии сероводорода с избытком аммиака:
Одной из наиболее характерных особенностей этого соединения является полное разложение соединения в воде. Цепь химической реакции выгладит следующим образом:
Сульфид аммиака в воде распадается на аммиак и сероводород.
Дальнейшее разложение сопровождается выделением водорода и появлением растворенного в воде аммиака и слабого аниона HS — . Поэтому в таблицах, поясняющих раствормость химических элементов, сульфид аммония помечен пропуском.
Практическое применение
В промышленности практическое применение разработано для паров сульфида аммония. Жидкая форма этого соединения используется при транспортировке. Хранят его в закрытых, химически инертных емкостях.
Это вещество хорошо знакомо фотографам и текстильщикам. В фотографии это соединение используется для обработки пленки. При взаимодействии с сильными основаниями происходит химическая реакция, сопровождающаяся выделением вредных веществ. В текстильной промышленности сульфид аммония используется как компонент отбеливающих смесей. Металлурги и реставраторы успешно пользуются им для превращения патины в бронзу. Сульфид аммония непременно используется при производстве мочевины, как важного удобрения, а также при производстве соды.
Возможно, применение этого вещества в хозяйственной деятельности было бы более распространенным. Но из-за чрезвычайной летучести этого соединения оно довольно быстро вступает в химическую реакцию с водяным паром, содержащимся в воздухе. Конечным продуктом этого взаимодействия является сероводород, который славится своим резким и очень неприятным запахом. Именно эта особенность сульфида аммония стала причиной его использования в производстве продукции для розыгрышей, включая «вонючие бомбы» и прочее.
http://chemege.ru/gidroksid-natriya/
http://www.syl.ru/article/225108/new_sulfid-ammoniya-poluchenie-gidroliz-primenenie